Применение вольфрама в промышленности
Вольфрам начали активно применять в различных сферах промышленности не так уж и давно. На протяжении долгого времени он не мог найти практического применения, но сейчас больше половины всего вольфрама идет на производство вольфрамовых сплавов различной прочности. Перечислим сферы и области применения вольфрама более подробно:
— электротехническая промышленность. Вольфрам незаменим в данной сфере, так как из его изготавливают нити накалывания электрических ламп, катоды рентгеновских трубок и различные детали для радиоламп.
— химическая промышленность. В данной сфере вольфрам применяют в качестве сырья для изготовления пигментов, красок и смазочных материалов. Помимо этого, данный неметаллический элемент применяют как катализатор.
— военная промышленность. Вольфрам был одним из основных сырьевых материалов в данной сфере во времена Первой Мировой войны. Его применяют для производства пуль, орудийной стали и бронебойных снарядов.
— автомобильная промышленность. Вольфрам выступает в качестве легированного элемента некоторых видов стали. Он придает стали уникальных свойств и позволяет использовать её для производства автомобильных прочных рессор. Более подробно об этом можно узнать в нашей статье «Сферы и области применения стали».
— железнодорожная промышленность. Вольфрамовая сталь применяется для производства железнодорожных рельс и вагонов. Такие рельсы могут выдержать очень большие нагрузки. Кроме того, их срок эксплуатации намного больше, чем из других видов стали.
— металлургическая промышленность
Наиболее важное предназначение вольфрама в металлургии – это легирование им сталей, а также производство твердых сплавов
Нахождение в природе
Месторождения
Геологическое строение земной коры таково, что наибольшие залежи вольфрамовых руд расположены в районах Альп, Гималаев, горных цепей региона Тихого океана. Это территории Казахстана (крупнейшее месторождение – Верхние Кайракты), Китая (наиболее продуктивное месторождение – Жианьши), Канады (месторождение Тангстен) и США (значительные запасы разведаны в месторождении Клаймакс).
Также имеются районы сосредоточения вольфрамитов и шеелитов на территории Боливии, Португалии, Великобритании, Турции, России, Узбекистана, Южной Кореи, Австралии.
В космосе
Прогресс не стоит на месте, а земные ресурсы распределены крайне неравномерно и достаточно ограничены. Освоение космического пространства, позволившее взять пробы с поверхностей ряда небесных тел близлежащих объектов Солнечной системы, дают все основания предполагать наличие огромного количества полезных ископаемых на астероидах, кометах и планетах.
Что открывает очень заманчивые перспективы их будущего освоения. Предполагается, что именно на астероидах содержится огромное количество минералов, причём очень высокой концентрации. В том числе и вольфрам. В связи с тем, что часть этих небесных тел вращаются в близости от Земли, перспективы их освоения становятся очень и очень заманчивыми.
Правительства целого ряда стран, международные космические сообщества и частные агентства активно формируют правовую базу, разрабатывают программы, отправляют миссии. Так Люксембург первым принял закон, разрешающий частную добычу полезных ископаемых в космосе. Активность в этом вопросе проявляют не только ведущие космические державы мира, но и Япония, Индия, Австралия, Израиль. Проводятся активные исследования поверхности Луны, Марса, Венеры.
Пока трудно ставить какую-либо оценку этим усилиям, так как на этом пути стоит множество организационных, технических и финансовых проблем. Хотя многие специалисты считают возможной добычу вольфрама в космосе в 21 веке.
Применение[ | ]
Главное применение вольфрама — как основа тугоплавких материалов в металлургии.
Металлический вольфрам
Нить накаливания
- Тугоплавкость вольфрама делают его незаменимым для нитей накаливания в осветительных приборах, а также в кинескопах и других вакуумных трубках.
- Благодаря высокой плотности вольфрам является основой тяжёлых сплавов, которые используются для противовесов, бронебойных сердечников подкалиберных и стреловидных оперенных снарядов артиллерийских орудий, сердечников бронебойных пуль и сверхскоростных роторов гироскопов для стабилизации полёта баллистических ракет (до 180 тыс. об/мин).
- Вольфрам используют в качестве электродов для аргонно-дуговой сварки.
- Сплавы вольфрама, ввиду его высокой температуры плавления, получают методом порошковой металлургии. Сплавы, содержащие вольфрам, отличаются жаропрочностью, кислотостойкостью, твердостью и устойчивостью к истиранию. Из них изготовляют хирургические инструменты (сплав «амалой»), танковую броню, оболочки торпед и снарядов, наиболее важные детали самолетов и двигателей, контейнеры для хранения радиоактивных веществ. Вольфрам — важный компонент лучших марок инструментальных сталей.
- Вольфрам применяется в высокотемпературных вакуумных печах сопротивления в качестве нагревательных элементов. Сплав вольфрама и рения применяется в таких печах в качестве термопары.
- Высокая плотность вольфрама делает его удобным для защиты от ионизирующего излучения. Несмотря на бо́льшую плотность по сравнению с традиционным и более дешёвым свинцом, защита из вольфрама оказывается менее тяжёлой при равных защитных свойствах или более эффективной при равном весе. Из-за тугоплавкости и твёрдости вольфрама, затрудняющих его обработку, в таких случаях используются более пластичные сплавы вольфрама с добавлением никеля, железа, меди и др. либо взвесь порошкообразного вольфрама (или его соединений) в полимерной основе.
Соединения вольфрама
- Для механической обработки металлов и неметаллических конструкционных материалов в машиностроении (точение, фрезерование, строгание, долбление), бурения скважин, в горнодобывающей промышленности широко используются твёрдые сплавы и композитные материалы на основе карбида вольфрама (например, победит, состоящий из кристаллов WC в кобальтовой матрице; широко применяемые в России марки — ВК2, ВК4, ВК6, ВК8, ВК15, ВК25, Т5К10, Т15К6, Т30К4), а также смесей карбида вольфрама, карбида титана, карбида тантала (марки ТТ для особо тяжёлых условий обработки, например, долбление и строгание поковок из жаропрочных сталей и перфораторное ударно-поворотное бурение крепкого материала). Широко используется в качестве легирующего элемента (часто совместно с молибденом) в сталях и сплавах на основе железа. Высоколегированная сталь, относящаяся к классу «быстрорежущая», с маркировкой, начинающейся на букву Р, практически всегда содержит вольфрам.
- Сульфид вольфрама WS2 применяется как высокотемпературная (до 500 °C) смазка.
- Некоторые соединения вольфрама применяются как катализаторы и пигменты.
- Монокристаллы вольфраматов (вольфраматы свинца, кадмия, кальция) используются как сцинтилляционные детекторы рентгеновского излучения и других ионизирующих излучений в ядерной физике и ядерной медицине.
- Дителлурид вольфрама WTe2 применяется для преобразования тепловой энергии в электрическую (термо-ЭДС около 57 мкВ/К).
Другие сферы применения
Искусственный радионуклид 185W используется в качестве радиоактивной метки при исследованиях вещества. Стабильный 184W используется как компонент сплавов с ураном-235, применяемых в твердофазных ядерных ракетных двигателях, поскольку это единственный из распространённых изотопов вольфрама, имеющий низкое сечение захвата тепловых нейтронов (около 2 барн).
Рынок вольфрама
Цены на металлический вольфрам (содержание элемента порядка 99 %) на конец 2010 года составляли около 40—42 долларов США за килограмм, в мае 2011 года составляли около 53—55 долларов США за килограмм. Полуфабрикаты от 58 USD (прутки) до 168 (тонкая полоса). В 2014 году цены на вольфрам колебались в диапазоне от 55 до 57 USD.
Свойства элемента
Как уже было сказано ранее, вольфрам – это один из самых тугоплавких металлов. Он имеет блестящий светло-серый цвет. Его температура плавления 3422°С, а кипения — 5555°C, плотность в чистом виде — 19,25 г/см3, а твердость 488 кг/мм². Это один из самых тяжелых металлов, обладающий высокой коррозионной стойкостью. Он практически не растворим в серной, соляной и плавиковой кислотах, но быстро вступает в реакцию с перекисью водорода. Что за металл вольфрам, если он не реагирует с расплавленными щелочами? Вступая в реакцию с гидроксидом натрия и кислородом, он образует два соединения – вольфрамат натрия и обычную воду Н2О. Интересно, что при повышении температуры вольфрам саморазогревается, тогда процесс происходит намного активнее.
Получение вольфрама
В чистом, самородном виде металл в природе не встречается. Большинство месторождений образовано оксидами. Содержание соединений в пересчете на чистый металл в рудном месторождении составляет 0.2 — 2%. Химическая стойкость и высокая температура плавления допускают получение вольфрама из руды только при использовании специфических методик.

Вольфрамовые прутки
В основе большинства методов промышленного получения вольфрама лежит восстановление металла из его оксида. Первая стадия производства состоит в обогащении вольфрамосодержащей руды. Затем при помощи операций выщелачивания и восстановления получают оксид WO3, который восстанавливают до чистого металла в атмосфере водорода. Температура процесса составляет около 700 °С.
В результате реакции получается тонкодисперсный металлический порошок. Высокая температура плавления не позволяет оформить металл в виде слитков, поэтому порошок вольфрама сначала прессуют под высоким давлением, а затем спекают в среде водорода, используя нагрев до температуры 1300 °С. Через полученные бруски пропускают мощный электрический ток. В результате высокого переходного сопротивления между зернами металла происходит нагрев и плавление заготовки.
Очистку полученного слитка производят методом зонной плавки, подобно технологии получения сверхчистых полупроводников. Производство вольфрама по данной технология позволяет получить металл высокой степени чистоты без дополнительных операций очистки.
При производстве сплавов, все составляющие добавляются еще перед стадией прессования порошка, поскольку в дальнейшем это сделать уже невозможно. В процессе прессовки, спекания и дальнейшей обработки заготовки (прессование, прокатка) обеспечивается равномерное распределение примесей в сплаве.

Вольфрам
Обработка вольфрама производится при температурах около полутора тысяч градусов. При таком нагреве металл становится очень пластичным и допускает ковку, штамповку. Тонкая проволока для спиралей ламп накаливания изготавливается методом волочения. При этом кристаллы металлы располагаются вдоль проволоки, повышая ее прочность. Поскольку к спиралям ламп предъявляются высоки требования по однородности, вольфрамовый провод дополнительно подвергают операциям электрохимического полирования.
Как используется
Свойства вольфрама обозначили главного потребителя. Это металлургия. Она создает конечный продукт и исходники для других отраслей промышленности.
Порошковый вольфрам – основа либо компонент твердых, жаропрочных износоустойчивых сплавов, премиальных марок сталей.
Металл, сплавы
Из тугоплавкого металла и сплавов создают широкий ассортимент продукции:
- Узлы и детали авиационных, ракетных двигателей.
- Элементы электровакуумных приборов (кинескопы, нити накаливания).
Нить накаливания из вольфрама
- Нагреватели вакуумных печей.
- Электроды для аргонно-дуговой сварки. Они не плавятся, создают прочный сварной шов. Пригодны для материалов любого состава (цветные металлы, легированные стали, другие).
- Емкости для радиоактивных продуктов. Здесь решающими оказались преимущества металла перед свинцом.
- Хирургический инструментарий.
Характеристики металла подошли оборонному комплексу: танковая, торпедная броня, крупнокалиберные снаряды, пули. А также суперскоростные роторы гироскопов, контролирующих траекторию полета баллистических ракет.
 Вольфрам в слитках
Вольфрам в слитках
Соединения
Обширен спектр применения вольфрамовых соединений:
- Без дителлурида невозможно преобразование тепла в электричество.
- Карбид – основа сплавов и композитов для механической обработки металлов и неметаллов. У горнодобытчиков, нефтяников, газовиков – для бурения скважин.
- Сульфид – термостойкая (до 500°C) смазка.
- Трехокись – материал для создания электролита топливных элементов, работающих при повышенных температурах.
Соединения вольфрама закупают производители лаков, красок, текстиля.
Другие формы
Изотоп W184 – компонент сплавов с изотопами урана. Из них делают ракетные двигатели на ядерном топливе.
Радионуклид искусственного происхождения (W185) востребован как детектор излучений (включая рентгеновское) ядерным сегментом физики и медицины.
Производство изделий из вольфрама
Полученный из первоначальной руды после описанных трех этапов производства монолитный вольфрам обладает уникальным набором свойств. Помимо тугоплавкости, ему присущи очень высокая стабильность геометрических размеров, сохранение прочности при высоких температурах и отсутствие внутреннего напряжения. Вольфрам также имеет хорошую пластичность и ковкость. Дальнейшее производство чаще всего заключается в вытягивании проволоки. Это технологически относительно несложные процессы.
- Заготовки поступают в ротационно-ковочную машину, где происходит обжатие материала.
- Затем методом волочения получают проволоку различного диаметра (волочение — это протягивание прута на специальном оборудовании через сужающиеся отверстия). Так можно получить тончайшую вольфрамовую проволоку с суммарной степенью деформации 99,9995%, при этом прочность ее может достигать 600 кг/мм².
Вольфрам начали использовать для нитей накала электрических ламп еще до разработки способа производства ковкого вольфрама. Русский ученый Лодыгин, ранее запатентовавший принцип применения нити накала для лампы, в 1890 годах предложил использовать в качестве такой нити скрученную в спираль вольфрамовую проволоку. Как же получали вольфрам для подобных проволок? Сначала приготовляли смесь вольфрамового порошка с каким-либо пластификатором (например парафином), затем из этой смеси выпрессовывали тонкую нить через отверстие заданного диаметра, просушивали и прокаливали в водороде. Получалась довольно хрупкая проволока, прямолинейные отрезки которой прикрепляли к электродам лампы. Были попытки получить компактный металл и другими методами, однако, во всех случаях хрупкость нитей оставалась критически высокой. После работ Кулиджа и Финка изготовление вольфрамовой проволоки обрело прочную технологическую базу, и промышленное применение вольфрама стало стремительно нарастать.

Лампа накаливания, изобретенная русским ученым Лодыгиным.
Вольфрам — самый тугоплавкий металл
Вольфрам — простое химическое вещество, элемент таблицы Менделеева, переходный металл. Записывается в виде латинской буквы W. Название получил от минерала вольфрамит, известного рудокопам с 16-го века. Сам минерал Wolf Rahm (в переводе с немецкого — «волчья пена») получил свое название из-за того, что осложнял получение олова из оловосодержащих пород. При выплавке примеси вольфрама образовывали соединения с оловом и поднимались на поверхность в виде пены; на языке рудокопов «пожирают олово как волк овцу».
Относится к редким элементам, по распространенности на планете занимает 57-е место. Встречается только в минералах, состоящих из соединений разных металлов. В добывающей индустрии наиболее значимы вольфрамит, шеелит, фербелит, гюбнерит. В месторождениях концентрация вольфрама редко превышает 2%.
Как отдельный химический элемент вольфрам был открыт в конце XVIII века. Известный шведский химик К. Шееле проводил эксперименты с минералом тунгстен (позже переименованным в его честь и названным шеелитом). Обработав его азотной кислотой, ученый выяснил, что образец представляет собой соль неизвестной кислоты. Его ученики продолжили работы с интересным минералом и через два года настойчивых исследований выделили неизвестный науке металл, который назвали вольфрамом. Большого шума это открытие не вызвало, т.к. новый металл был чрезвычайно тугоплавким и в мире просто еще не существовало печей, способных обеспечить необходимую температуру для выплавки. Зато в ХХ веке вольфрам произвел в промышленности настоящую революцию.
| Электропечи с максимальной температурой нагрева +1300 °С | Электропечи с максимальной температурой нагрева +1100 °С |
Свойства
Светло-серебристый блестящий металл, напоминающий платину. Очень плотный, тяжелый, твердый, но, при этом, хрупкий. Плавится при t около +3400 °C, это самый высокий показатель среди металлов. (Теоретически более тугоплавким может быть трансактиноид сиборгий, но это короткоживущий радиоактивный элемент №106, получаемый искусственно в результате ядерного синтеза.) В нормальных условиях вольфрам плохо поддается механической обработке, зато при нагреве свыше +1600 °С его можно ковать, прокатывать, вытягивать в тонкую нить. Парамагнетик (может намагничиваться во внешнем магнитном поле), обладает высоким электрическим сопротивлением.
В химических реакциях может проявлять валентность от 2 до 6, но все устойчивые соединения образованы W (VI). При температуре в районе +20 °С не поддается коррозии в воде и на воздухе. Очень слабо реагирует с соляной, фтороводородной и неконцентрированной серной кислотами. А вот с перекисью водорода, азотной кислотой, смесью азотной и фтороводородной кислот, «царской водкой» взаимодействует легко. При высокой t и в присутствии окислителей вступает в реакции со щелочами. Образует оксиды, вольфраматы (соли вольфрамовых кислот), соединения с галогенами, серой, углеродом.
В метаболизме животных и человека не участвует.
Вольфрамовая пыль, как и пыль любого другого металла, оказывает раздражающее влияние на органы дыхания.
Это интересно
На Земле существует несколько типов архебактерий и бактерий, использующих в своих обменных процессах ферменты с вольфрамом. Ученые считают, что они ведут свое развитие с ранней архейской эры (около 4 млрд. лет назад), когда этот металл играл важную роль в создании и развитии жизни на планете.
Вольфрам — крайне востребованный в промышленности металл. Подробнее о его применении мы расскажем в следующей статье.
§3. Вольфрамовая проволока
Производство Вольфрамовая проволока — один из самых распространенных видов продукции из данного тугоплавкого металла. Исходным материалом для ее изготовления являются кованые вольфрамовые прутки диаметром 2,75 мм.
Волочение проволоки производится при температуре 1000 °С в начале процесса и 400-600 °С — в конце. При этом нагревается не только проволока, но и фильера. Нагрев осуществляется пламенем газовой горелки или электрическим нагревателем.
Волочение проволоки диаметром до 1,26 мм ведут на прямолинейном цепном волочильном стане, в пределах диаметра 1,25-0,5 мм — на блочном стане с диаметром катушки ~1000 мм, диаметра 0,5-0,25 — на машинах однократного волочения.
В результате ковки и волочения структура заготовки превращается в волокнистую, которая состоит из осколков кристаллов, вытянутых вдоль оси обработки. Такая структура приводит к резкому повышению прочности проволоки из вольфрама.
После волочения вольфрамовая проволока покрыта графитовой смазкой. Поверхность проволоки необходимо очистить. Очистку производят с помощью отжига, химического или электролитического травления, электролитической полировки. Полировка может увеличить механическую прочность вольфрамовой проволоки на 20-25%.
Применение
Вольфрамовая проволока используется для изготовления элементов сопротивления в нагревательных печах, работающих в атмосфере водорода, нейтрального газа или в вакууме при температурах до 3000 °С. Также проволока из вольфрама служит для производства термопар. Для этого используются вольфрам-рениевый сплав с 5% рения и вольфрам-рениевый сплав с 20% рения (ВР 5/20). В ГОСТ 18903-73 “Проволока вольфрамовая. Сортамент” указаны области применения проволоки марок ВА, ВМ, ВРН, ВТ-7, ВТ-10, ВТ-15. Вольфрамовая проволока ВА в зависимости от группы, состояния поверхности и металла, диаметра применяется для изготовления спиралей ламп накаливания и других источников света, спиралеобразных катодов и подогревателей электронных приборов, пружин полупроводниковых приборов, петлевых подогревателей, неспиралеобразных катодов, сеток, пружин электронных приборов. Проволока марки ВРН применяется при получении вводов, траверсов и других деталей приборов, не требующих применения вольфрама со специальными присадками.
ПРИМЕНЕНИЕ

Тугоплавкость и пластичность вольфрама делают его незаменимым для нитей накаливания в осветительных приборах, а также в кинескопах и других вакуумных трубках. Благодаря высокой плотности вольфрам является основой тяжёлых сплавов, которые используются для противовесов, бронебойных сердечников подкалиберных и стреловидных оперенных снарядов артиллерийских орудий, сердечников бронебойных пуль и сверхскоростных роторов гироскопов для стабилизации полёта баллистических ракет (до 180 тыс. об/мин).
Вольфрам используют в качестве электродов для аргоно-дуговой сварки. Сплавы, содержащие вольфрам, отличаются жаропрочностью, кислотостойкостью, твердостью и устойчивостью к истиранию. Из них изготовляют хирургические инструменты (сплав «амалой»), танковую броню, оболочки торпед и снарядов, наиболее важные детали самолетов и двигателей, контейнеры для хранения радиоактивных веществ. Вольфрам — важный компонент лучших марок инструментальных сталей. Вольфрам применяется в высокотемпературных вакуумных печах сопротивления в качестве нагревательных элементов. Сплав вольфрама и рения применяется в таких печах в качестве термопары.
Для механической обработки металлов и неметаллических конструкционных материалов в машиностроении (точение, фрезерование, строгание, долбление), бурения скважин, в горнодобывающей промышленности широко используются твёрдые сплавы и композитные материалы на основе карбида вольфрама (например, победит, состоящий из кристаллов WC в кобальтовой матрице; широко применяемые в России марки — ВК2, ВК4, ВК6, ВК8, ВК15, ВК25, Т5К10, Т15К6, Т30К4), а также смесей карбида вольфрама, карбида титана, карбида тантала (марки ТТ для особо тяжёлых условий обработки, например, долбление и строгание поковок из жаропрочных сталей и перфораторное ударно-поворотное бурение крепкого материала). Широко используется в качестве легирующего элемента (часто совместно с молибденом) в сталях и сплавах на основе железа. Высоколегированная сталь, относящаяся к классу «быстрорежущая», с маркировкой, начинающейся на букву Р, практически всегда содержит вольфрам. ( Р18, Р6М5. от rapid — быстрый, скорость).
Сульфид вольфрама WS2 применяется как высокотемпературная (до 500 °C) смазка. Некоторые соединения вольфрама применяются как катализаторы и пигменты. Монокристаллы вольфраматов (вольфраматы свинца, кадмия, кальция) используются как сцинтилляционные детекторы рентгеновского излучения и других ионизирующих излучений в ядерной физике и ядерной медицине.
Дителлурид вольфрама WTe2 применяется для преобразования тепловой энергии в электрическую (термо-ЭДС около 57 мкВ/К). Искусственный радионуклид 185W используется в качестве радиоактивной метки при исследованиях вещества. Стабильный 184W используется как компонент сплавов с ураном-235, применяемых в твердофазных ядерных ракетных двигателях, поскольку это единственный из распространённых изотопов вольфрама, имеющий низкое сечение захвата тепловых нейтронов (около 2 барн).
Вольфрам (англ. Tungsten) — W
| Молекулярный вес | 183,84 г/моль |
| Происхождение названия | лат. Spuma lupi («волчья пена») или нем. Wolf Rahm («волчьи сливки», «волчий крем») |
| IMA статус | подтвержден в 2011 году |
Физические свойства, особенности
Карбидные материалы обладают рядом характерных свойств, особенностей. Перечислим их:
- Высокая твердость. Атомы углерода и металлов образуют твердую кристаллическую решётку, для разрушения которой потребуется большое механическое усилие. Поэтому с помощью ударов разрушить карбидные вещества будет крайне сложно. Благодаря высокой твердости материалы нашли широкое распространение в различных технических сферах (от военного машиностроения до строительства).
- Высокая температура плавления. Плотная кристаллическая решетка обеспечивает устойчивость вещества при сильном нагреве или охлаждении. Средняя температура плавления карбидов находится в пределах от 1500 до 2000 градусов. Поэтому такой материал без проблем выдержит длительное воздействие экстремальных температур (скажем, его можно использовать в печах, металлургических ковшах для расплавления других материалов).
- Устойчивость к химическим веществам и коррозии. Внешние электронные оболочки веществ-карбидов являются полностью заполненными. Поэтому такой материал будет редко вступать в химические реакции с другими веществами (он устойчив к воздействию кислот, щелочей, солей). Вещества не вступают в реакцию с водой и атмосферным кислородом, поэтому они не покрываются ржавчиной, что обеспечивает их высокий срок годности.
- Повышенная износоустойчивость. Изделия на основе карбидов долгое время сохраняют свою форму даже в случае удара, деформации или воздействия высоких температур. Поэтому они обладают повышенной износоустойчивостью, что делает их срок годности большим. Благодаря повышенной устойчивости материал часто применяют для изготовления абразивных и шлифовальных изделий, которыми можно пользоваться в течение большого срока.
Стоит обратить внимание, что далеко не все карбидные соединения обладают перечисленными свойствами. Скажем, карбид золота (I) чрезвычайно взрывоопасен (тогда как большинство других карбидов металлов — нет)
Он может взорваться даже в случае неаккуратного пересыпания вещества на бумажную поверхность. Поэтому при рассмотрении физических и химических свойства карбидов нужно по отдельности рассматривать каждое соединение, поскольку карбидные материалы могут обладать уникальными необычными свойствами.
Свойства вольфрама (таблица): температура, плотность, давление и пр.:
Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения | |
| 101 | Название | Вольфрам |
| 102 | Прежнее название | |
| 103 | Латинское название | Wolframium |
| 104 | Английское название | Tungsten |
| 105 | Символ | W |
| 106 | Атомный номер (номер в таблице) | 74 |
| 107 | Тип | Металл |
| 108 | Группа | Переходный металл |
| 109 | Открыт | Карл Вильгельм Шееле, Швеция, 1781 г., Хуан Хосе Эльхуяр Любизе и Фаусто де Эльхуяр, Испания, 1783 г. |
| 110 | Год открытия | 1783 г. |
| 111 | Внешний вид и пр. | Твёрдый, тугоплавкий, блестящий серебристо-серый металл |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | 2 аллотропные модификации: – α-вольфрам с кубической объёмно-центрированной кристаллической решёткой,
– β-вольфрам с кубической кристаллической решёткой, именуемой фаза А15 |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,00011 % |
| 120 | Содержание в морях и океанах (по массе) | 1,2·10-8 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 5,0·10-8 % |
| 122 | Содержание в Солнце (по массе) | 4,0·10-7 % |
| 123 | Содержание в метеоритах (по массе) | 0,000012 % |
| 124 | Содержание в организме человека (по массе) | |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 183,84(1) а. е. м. (г/моль) |
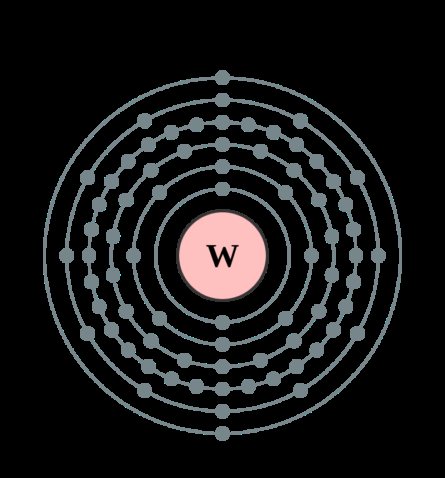
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d4 6s2 |
| 203 | Электронная оболочка | K2 L8 M18 N32 O12 P2 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 193 пм |
| 205 | Эмпирический радиус атома* | 135 пм |
| 206 | Ковалентный радиус* | 162 пм |
| 207 | Радиус иона (кристаллический) | W4+ 80 (6) пм,
W5+ 76 (6) пм, W6+ 74 (6) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | |
| 209 | Электроны, Протоны, Нейтроны | 74 электрона, 74 протона, 110 нейтронов |
| 210 | Семейство (блок) | элемент d-семейства |
| 211 | Период в периодической таблице | 6 |
| 212 | Группа в периодической таблице | 6-ая группа (по старой классификации – побочная подгруппа 6-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | -4, -2, -1, 0, +1, +2, +3, +4, +5, +6 |
| 302 | Валентность | II, III, IV, V, VI |
| 303 | Электроотрицательность | 2,3 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 758,76 кДж/моль (7,86403(10) эВ) |
| 305 | Электродный потенциал | W3+ + 3e– → W, Eo = +0,11 В, W6+ + 6e– → W, Eo = +0,68 В |
| 306 | Энергия сродства атома к электрону | 78,6 кДж/моль |
| 400 | Физические свойства | |
| 401 | Плотность* | 19,3 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело), 17,6 г/см3 (при температуре плавления 3422 °C и иных стандартных условиях, состояние вещества – жидкость) |
| 402 | Температура плавления* | 3422 °C (3695 K, 6192 °F) |
| 403 | Температура кипения* | 5930 °C (6203 K, 10706 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 52,31 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 774 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,114 Дж/г·K (при 0-1000 °C) |
| 410 | Молярная теплоёмкость | 24,27 Дж/(K·моль) |
| 411 | Молярный объём | 9,53 см³/моль |
| 412 | Теплопроводность | 173 Вт/(м·К) (при стандартных условиях), 162,8 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
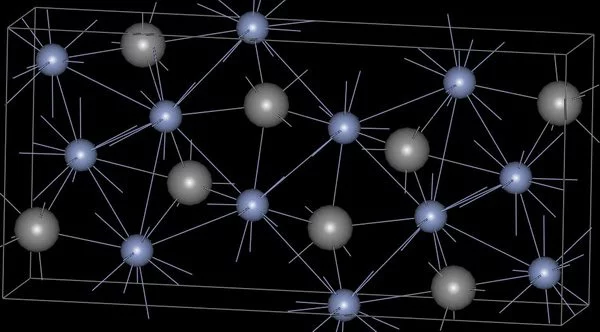
| 511 | Кристаллическая решётка #1 | α-вольфрам |
| 512 | Структура решётки | Кубическая объёмно-центрированная
|
| 513 | Параметры решётки | 3,160 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 310 K |
| 516 | Название пространственной группы симметрии | Im_ 3m |
| 517 | Номер пространственной группы симметрии | 229 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-33-7 |
Примечание:
205* Эмпирический радиус вольфрама согласно и составляет 139 пм и 137 пм соответственно.
206* Ковалентный радиус вольфрама согласно и составляет 162±7 пм и 170 пм соответственно.
401* Плотность вольфрама согласно и составляет 19,25 г/см3 (при 0 °C и иных стандартных условиях, состояние вещества – твердое тело) и 19,32 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело) соответственно.
402* Температура плавления вольфрама согласно составляет 3420 °C (3693,15 K, 6188 °F).
403* Температура кипения вольфрама согласно и составляет 5555 °C (5828 K, 10031 °F) и 5680 °C (5953,15 K, 10256 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) вольфрама согласно составляет 61,5 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) вольфрама согласно и составляет 824 кДж/моль и 769 кДж/моль соответственно.