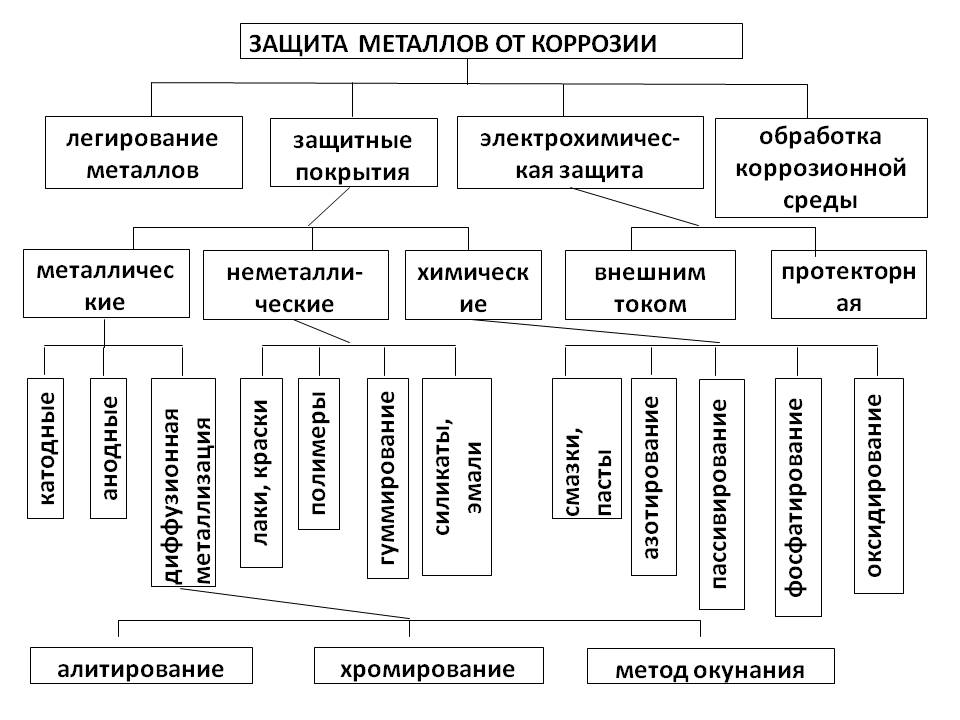
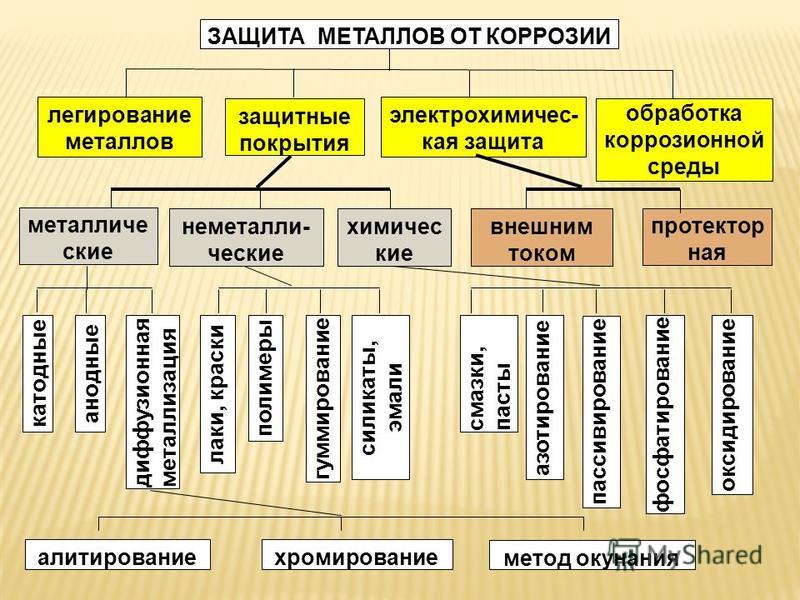
Меры защиты от почвенной коррозии
Для предотвращения почвенной коррозии, в первую очередь, необходимо правильно выбрать маршрут прокладки кабельной трассы. Он не должен проходить в болотистой местности, в грунтах с повышенным содержанием влаги и извести. Также следует избегать участков с повышенным загрязнением, в том числе районы свалок бытовых и промышленных отходов, стока промышленных вод, мест с насыпными грунтами, включающими шлаки и т.д.
Если прокладку трассы мимо таких мест не удается обеспечить, то рекомендуется использовать кабельную продукцию с защитным пластиковым покрытием оболочки. При расположении в грунтах с повышенным содержанием агрессивных веществ эффективную защиту металлических оболочек кабелей дает прокладка внутри асбестоцементных труб.
Дополнительно может потребоваться использование электрических способов защиты от коррозии.
Виды коррозии кабельной продукции
Применяемые способы защиты кабелей от коррозии зависят от того, какому именно типу коррозионного воздействия подвержена линия электропередачи. Это определяется местом ее прокладки, условиями эксплуатации и материалами кабеля.

Коррозия металлической оболочки кабеля
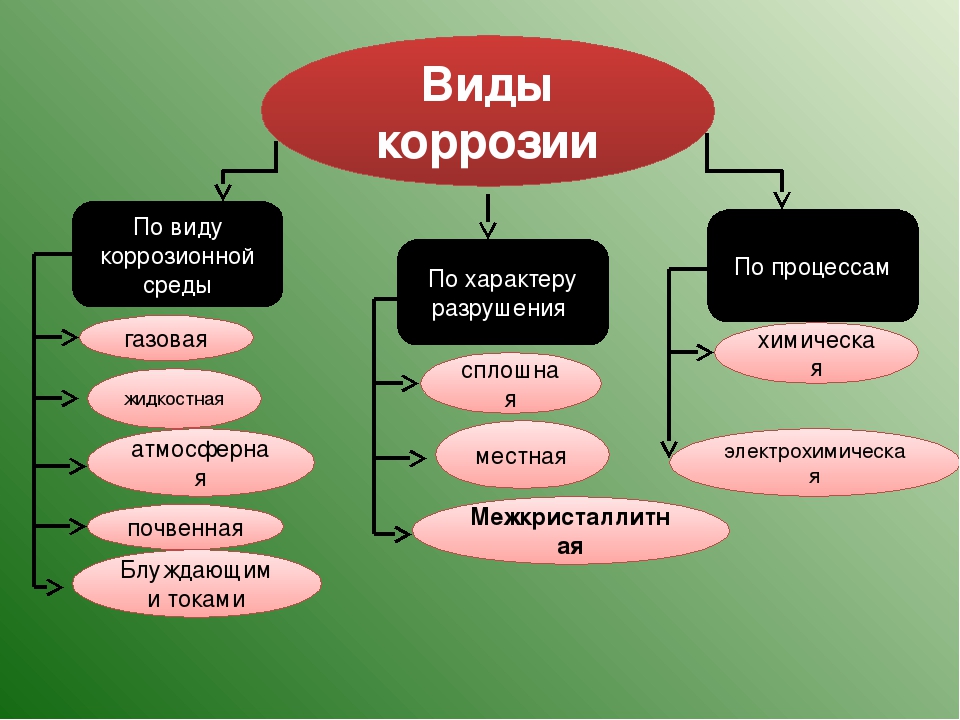
Различают следующие основные виды коррозии:
- электрохимическая (почвенная);
- электрическая;
- межкристаллитная.
Причиной почвенной коррозии металлических оболочек и брони кабелей является воздействие агрессивных веществ, содержащихся в грунте. В почве постоянно присутствуют соли, щелочи, кислоты, которые выступают в качестве электролита. При контакте этих веществ с металлом на его поверхности образуются микроскопические гальванические элементы, в которых в качестве электродов выступают разные по структуре зерна металла или зерна металла и содержащиеся в его составе примеси. Протекание токов между этими электродами обуславливает быструю коррозию. Свинцовая кабельная оболочка быстрее всего разрушается при наличии в почве нитратов, извести и известняка, уксусной кислоты, доменных шлаков и каменноугольной смолы, большой концентрации перегноя. Стальная броня плохо переносит присутствие в грунте серных и сернокислых соединений, а также соединений хлора. Алюминиевые оболочки быстро корродируют во влажной почве, независимо от ее состава.
Электрическая коррозия протекает в результате воздействия на металлическую оболочку или броню кабеля блуждающих токов. Эти токи образуются в результате эксплуатации рельсового транспорта на электрическом ходу. Рельсы выступают в качестве обратных проводов, по которым ток возвращается на тяговую подстанцию. При этом существенная доля тока уходит в землю, образуя блуждающие токи. При наличии в зоне их действия кабеля с металлической оболочкой или броней возникает коррозия. За год блуждающий ток силой 1 А способен разрушать 3 кг алюминия, 9 кг стали, 35 кг свинца. При этом в некоторых случаях сила блуждающих токов может составлять несколько десятков ампер.
Межкристаллитная коррозия характерна для свинцовой брони и кабельных оболочек. Она возникает в результате длительного воздействия вибрации. Наибольшей угрозе подвержен кабель, проложенный вблизи железнодорожных и автомобильных магистралей, трамвайных путей, на мостах и т.д. При длительном воздействии вибрационных нагрузок свинцовая оболочка может растрескиваться. Причем трещины проходят, как правило, по границам зерен металла (кристаллитов), вследствие чего между ними начинают протекать коррозионные процессы, которые дополнительно усиливаются образованием окиси свинца.
Меры защиты от электрической коррозии
Для предотвращения этого типа коррозии используются способы электрической защиты кабеля, которые также применяют и для защиты от химической коррозии.
Суть электрической защиты заключается в подаче отрицательного потенциала на металлическую оболочку кабеля, что позволяет прекратить на ее поверхности электролитические процессы.
Электрическую защиту подразделяют на три типа:
- катодная;
- протекторная;
- дренажная.
При катодной защите земля работает как катод. Между оболочкой кабеля и грунтом при помощи специальной катодной станции прикладывается разница потенциалов, что приводит к возникновению постоянного тока. Его протекание от почвы на кабель обеспечивает поляризацию.
Протекторная защита от коррозии не требует использования внешнего источника поляризационного тока. В качестве него используется гальванический элемент, который формируется металлической оболочкой кабеля («катод») и специальным металлическим элементом («анод»). Между ними в среде электролита возникает разница потенциалов. В результате протекания поляризационного тока происходит реакция восстановления металла кабельной оболочки и окисления протектора. Для защиты металлической оболочки кабелей от коррозии в зоне действия блуждающих токов промышленной частоты используются не обычные, а поляризованные протекторы. Их особенностью является подключение к кабельной оболочке через диод.
Электрический дренаж — это способ защиты кабеля от коррозии, предусматривающий отвод блуждающих токов при помощи проводника. Дренажный проводник подключается к металлической оболочке кабеля в центральной части анодной зоны, где накапливается наиболее значительный потенциал по отношению к земле. По этому проводнику блуждающие токи отводятся к минусовой шине подстанции или к рельсам.
1 Общая информация о катодной защите
Впервые такая защита металлов была описана в 1820-х годах Гемфри Дэви. На основании его докладов в 1824 году на корабле HMS Samarang осуществили проверку предоставленной теории. На медную обшивку корабля установили железные анодные протекторы, которые существенно уменьшили скорость ржавления меди. Методику стали развивать, и в наши дни катодная антикоррозионная защита всевозможных конструкций из металлов (трубопроводов, элементов автомобиля и т. д.) признается наиболее эффективной и широко используемой.
В производственных условиях такая защита металлов (ее нередко называют катодной поляризацией) производится по двум основным методикам.
- Предохраняемая от разрушения конструкция подключается к внешнему источнику тока. В данном случае металлоизделие выполняет функцию катода. А анодами являются инертные дополнительные электроды. Эта методика обычно применяется для защиты трубопроводов, металлических сварных оснований, платформ для бурения.
- Катодная поляризация гальванического типа. При такой схеме металлическая конструкция контактирует с металлом, который имеет больший электроотрицательный потенциал (алюминий, магний, алюминиевые сплавы, цинк). При этом под анодом понимают оба металла (основной и защитный). Растворение (имеется в виду сугубо электрохимический процесс) электроотрицательного материала приводит к протеканию через предохраняемое изделие необходимого катодного тока. С течением времени происходит полное разрушение металла-«защитника». Гальваническая поляризация эффективна для конструкций, на которых есть изоляционный слой, а также для металлоизделий относительно малых размеров.
Катодная поляризация металла
Первая методика нашла широкое применение по всему миру. Она достаточно проста и экономически целесообразна, дает возможность предохранять металл от общей коррозии и от многих ее разновидностей – межкристаллитной коррозии «нержавейки», питтинговой, растрескивания латунных изделий, обусловленного напряжениями, при которых они работают.
Гальваническая схема нашла большее применение в США. В нашей стране она используется реже, хотя ее эффективность высока. Ограниченное применение протекторной защиты металлов в России связано с тем, что на многие трубопроводы у нас не наносят специальное покрытие, а это является обязательным условием для реализации антикоррозионной гальванической методики.
https://youtube.com/watch?v=ZWVg2xaUSn4
Краски для покрытия металлических изделий
Краски, предназначенные для обработки металлических поверхностей, бывают обычными и термостойкими. В большинстве случаев применяются три типа составов: эпоксидные, акриловые и алкидные. Есть и специальные краски антикоррозийного типа, которые обладают следующими достоинствами:
- эффективно защищают покрытие от атмосферных воздействий и перепадов температур;
- с легкостью наносятся валиком, кисточкой или распылителем;
- многие из них являются быстросохнущими;
- обладают широким выбором расцветок;
- отличаются долговечностью.
Что касается самых недорогих и доступных средств, то тут следует обратить внимание на обыкновенную серебрянку. В составе этого покрытия есть алюминиевая пудра, образующая защитную пленку на обработанном им изделии
Этапы работ по борьбе с коррозией в быту
Методы борьбы с коррозией металлов предполагают определенную последовательность. Следует перечислить основные этапы этой работы:
-
Перед тем как наносить преобразователь или грунтовую смесь, поверхность необходимо полностью очистить от маслянистых пятен, следов коррозии и различного рода загрязнений. Для этих мер можно воспользоваться болгаркой или щетками с металлическим ворсом.
- После этого можно приступать к нанесению слоя грунтовки, которая затем должна впитаться и как следует просохнуть.
- Далее на поверхность наносится пара слоев. Перед тем как наносить второй слой, нужно дождаться полного высыхания первого. В процессе работы обязательно нужно пользоваться защитными очками, перчатками и специальным респиратором, так как все применяемые вещества и составы являются токсичными.
Антикоррозийная защита металлических сплавов — очень непростой процесс. В промышленности он начинается на стадии расплавления стали. Производители ЛКМ-покрытий занимаются совершенствованием своей продукции, увеличивая ее долговечность и стойкость.
Катодная защита от коррозии автомобиля нержавейка – Справочник металлиста
Главной болезнью любого автомобиля является коррозия. На советских машинах признаки её появления проявляются раньше, на европейских — немного позже, а модели японского автопрома считаются наиболее защищёнными. Но все они рано или поздно начинают покрываться рыжими коррозийными пятнами.
Устранение таких дефектов становится дорогостоящей проблемой, на которую некоторые автовладельцы просто закрывают глаза. А выбором других становится катодная защита от коррозии. Эта тема интересна для каждого водителя, который желает сохранить как можно дольше первоначальный внешний вид авто.
Как действует защита
Способ защиты, который лёг в основу этой статьи, является активным методом, основанным на электрохимических законах. Изначально таким образом защищали трубопроводы и различного рода конструкции из металла. Со временем катодная защита металлов от коррозии перекочевала и в автомобильную сферу.
В основе лежат особенности протекания реакций окислительно-восстановительного характера. Для организации защиты на металлический объект накладывается отрицательно заряженный заряд.
Также необходимо присутствие сдвига потенциала, который может быть создан двумя способами: использованием внешнего тока или соединением с протекторным анодом, конструкция которого состоит из металла с более высоким уровнем электроотрицательности по сравнению с автомобилем.
Принцип работы катодной защиты основан на слабом токе, который проходит через влажный воздух от автомобиля к окружающим предметам.
В результате кузов с низкой электроотрицательностью восстанавливается за счёт окисления металла с высокой электроотрицательностью.
Скидки на новые автомобили! Выгодный кредит от 9.9% Рассрочка 0%
Подобная защита автомобиля от коррозии требует осторожного подхода, тщательного изучения теории и точного соблюдения правил её организации. Стоит создать слишком большой сдвиг потенциала и результат будет полностью противоположным
Начнёт выделяться водород, состав электродного слоя изменится, покрытие автомобиля подвергнется деградации и на нём появятся следы стресс-коррозии.
Как сделать устройство для катодной защиты самому
Если не ставить перед собой цель изготовления системы со сложными блокировками от короткого замыкания, слежением за расходом заряда батареи, светодиодной индикацией, то само устройство можно элементарно изготовить и самому.
Катодная защита кузова (схема)
Простейший вариант включает лишь разгрузочный резистор определенного номинала (500-1000 ом), через который плюсовая клемма аккумулятора соединяется с защитными электродами. Потребляемый ток должен находиться в интервале 1-10 мА. Защитный потенциал теоретически достаточен в размере 0,44 В (величина электроотрицательного потенциала чистого железа). Но с учетом сложного состава стали, наличия дефектов кристаллической структуры и иных действующих факторов принимается в районе 1,0 В.
Лучшие гелевые преобразователи ржавчины
Благодаря высокой вязкости гелевые средства отлично подходят для нанесения кисточкой на вертикальную и наклонную поверхность. За счет специальных присадок, входящих в состав модификатора он не растекается и не оставляет непривлекательных потеков. Но при этом равномерно наносится на обрабатываемую поверхность, что обеспечивает более продолжительное и эффективное воздействие на очаг коррозии.
Permatex Rust Treatment 81849
Препарат эффективно борется с проявлениями коррозии и превращает ржавчину в грунт под покраску. Гель наносится при помощи кисточки или шпателя и не стекает даже с вертикальных поверхностей.
Высокая концентрация действующих веществ позволяет применять преобразователь даже на мокром металле. Перед нанесением необходимо удалить толстый рыхлый слой ржавчины, окалины и краску. Через 15-20 минут обрабатываемая поверхность должна приобрести равномерный темный оттенок, если этого не произошло – процедуру следует повторить. Препарат применяется в промышленности и быту. Подходит для обработки любых металлических конструкций.
Преимущества:
- не требует тщательной очисти поверхности;
- можно применять как грунтовку перед покраской;
- дает быстрый эффект;
- не растекается и не пузырится.
Несмотря на свои достоинства, у средства замечена и пара недостатков. Первый – дороговизна. Второй – для нормальной защиты потребуется нанести вещество в два слоя.
Kudo KU-70005
Прекрасный гелевый модификатор от отечественного производителя. Выпускается в удобной таре 15 мл с кисточкой. Используется для удаления следов коррозии на черных металлах. Активные вещества легко просачиваются вглубь ржавчины и превращают ее в нейтральный защитный слой.
Для увеличения эффекта рекомендуется нанести два слоя с интервалом 10 – 15 мин. Остатки следует тщательно смыть водой. Образовавшаяся пленка увеличивает сцепление металла с лакокрасочным материалом. Покрасочные работы можно проводить через 48 часов после высыхания поверхности.
Преимущества:
- удобно наносить;
- маленький объем удобно возить с собой;
- хорошее проникновение;
- мгновенный результат;
- невысокая цена.
Вершина «Уничтожитель ржавчины» В-52
Универсальный гелевый модификатор. Основа состава — это минеральные кислоты, соли и специальные присадки. Подходит для обработки железных, медных, тканевых, стеклянных и других поверхностей. Эффективно справляется даже с самыми запущенными очагами коррозии.
Перед обработкой ржавую поверхность следует тщательно зачистить наждачкой. После полного высыхания состава можно окрашивать. Гель легко наносится на любые поверхности и не растекается.
Преимущества:
- универсальный состав;
- удобное нанесение;
- экономно расходуется;
- относительно невысокая стоимость.
Из недостатков отмечена необходимость смывать остатки препарата после использования. К тому же он имеет неприятный запах.
Как защитить машину
Каждый владелец автомобиля сам выбирает, как защитить авто от коррозии. Выделяется три метода:
- Пассивный – машина изолируется от вредного воздействия окружающей среды
- Активный – проводятся систематические работы по целенаправленной защите металлических деталей автомобиля
- Преобразующий – ведется борьба с уже появившейся ржавчиной: механическое удаление, превращение в твердый слой под покраску при помощи модификаторов ржавчины, выжигание
Каждый метод борьбы предполагает наличие определенных способов, которыми осуществляется защита от коррозии. Лучше всего работает активный метод, который постоянно совершенствуется. На сегодняшний день самой перспективной считается электрохимическая защита кузова от коррозии.
Составные элементы катодной защиты
Есть обязательные составляющие, без которых защита просто не будет функционировать.
Катод и анод
Катодом в нашей схеме защиты является сам автомобиль, он будет служить минусом. Анодом может быть любая металлическая конструкция, пластина и любая поверхность, которая способна проводить электрический ток, даже мокрый асфальт. Без этих двух составляющих электрохимическая защита автомобиля от коррозии просто не будет функционировать.
От некоторых специалистов можно услышать про разность потенциалов и степень защиты, которая определяется этим показателем. Железо будет защищено от коррозии при величине потенциалов в пределах 0,1–0,2 В. На самом деле расстояние, которое находится между анодом и катодом, может достигать нескольких сантиметров и даже метров. Чем больше расстояние между электродами, тем большей должен быть показатель разницы потенциалов. Да и воздух не будет проводить ток небольшого напряжения, разница потенциалов должна быть на уровне киловольта.

Что действительно влияет на эффективность защиты автомобиля, так это площадь анода. Чем она больше, тем катодная защита автомобиля от коррозии будет лучше проявляться.
Электрический ток
Чтобы схема исправно работала, электрический ток между двумя электродами не нужен. Даже если он и возникнет, то будет носить характер побочного продукта. Такой ток может образоваться от мокрого анода, намокших колёс машины и т. д. А проявляться он будет на аккумуляторе, который разрядится быстрее обычного.

Чтобы установка катодной защиты не принесла вреда автомобилю, а работала в нужном нам направлении, потребуется бортовую систему соединить с анодом посредством добавочного резистора. Такое устройство позволит ограничить разряд аккумулятора в том случае, если анод будет замкнут на катоде. Причиной такой ситуации может быть неправильно собранная схема, выход из строя анода, например, полное окисление вплоть до разложения.
Как обеспечить протекторную защиту
Покрытие труб специальными составами — это задача не только производителя, в процессе эксплуатации конструкции обеспечение защитных свойств тоже должно выполняться. Всего существует несколько способов защиты металла от воздействия агрессивных сред:
- химическая обработка;
- покрытие стенок специальными составами;
- защита от блуждающих токов;
- подведение катода или анода.

О пассивных и активных способах
Антикоррозионная защита — это целый комплекс мероприятий, проводимых предприятиями. Пассивные методы защиты предполагают выполнение следующих работ:
- На стадии монтажа между трубопроводом и грунтом оставляют воздушный зазор, препятствующий попаданию грунтовой воды, в том числе в составе с кислотными и щелочными примесями.
- Покрытие специализированными составами, назначение которых распространяется от негативных воздействий почвы.
- Обработка металла химическими составами, с образованием тонкой пленки.

Активные способы защиты предусматривают использование тока и обмен ионов на основе химических реакций, за счет чего обеспечивается:
- Защита подземных трубопроводов от коррозии созданием электродренажной системы для изоляции трубопроводного транспорта от блуждающих токов.
- Защита анодом от разрушения металлических поверхностей.
- Катодная защита для увеличения сопротивления металлических оснований.
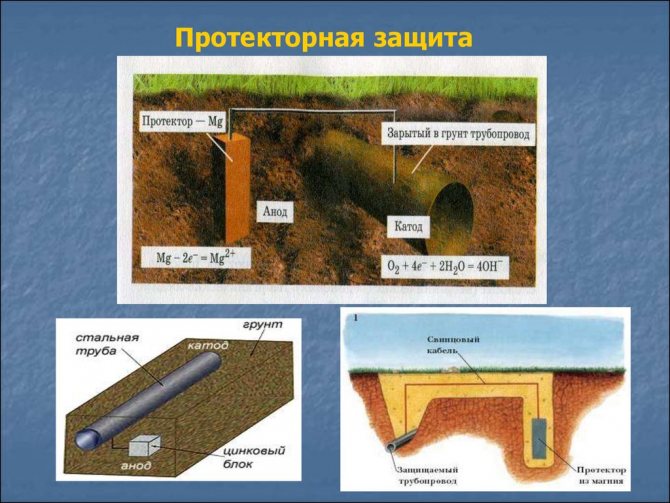
Только с учетом всех способов, препятствующих образованию ржавчины на металле, будет увеличен срок службы конструкций. Антикоррозионная защита трубопроводов должна выполняться комплексно.
На видео: защита трубопроводов и кабельных линий от электрической коррозии.
О достоинствах применения протекторов
Защита труб этим способом производится с добавлением компонента — ингибитора. Это материал с отрицательным электрическим зарядом. Под воздействием воздушных масс он растворяется, а конструкция остается целой и не подвергается ржавлению. Протекторная защита от коррозии применяется для продления срока службы строительных конструкций, систем отопления и водоснабжения, а также магистрального и промыслового трубопроводного транспорта.
Применение электрохимической защиты позволяет устранить причины многих видов коррозии. Такая антикоррозийная защита трубопроводов – неплохое решение даже для предприятий, не имеющих финансовых возможностей по обеспечению полноценной защиты от неконтролируемого процесса.
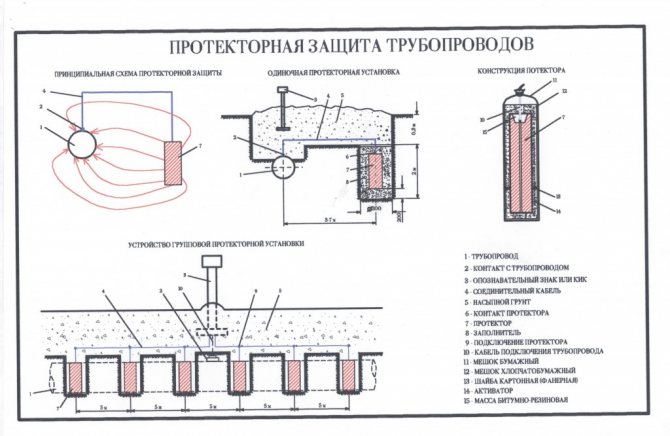
Для обеспечения грамотного подхода следует:
- Протекторы, изготовленные из алюминия, использовать в средах морских вод и прибрежных шельфах.
- В средах с небольшой электропроводностью использовать магниевые протекторы. Но, опять же, они не подходят для обработки внутреннего покрытия резервуаров, нефтяных отстойников в связи с тем, что обладают достаточно низкой взрывопожароопасностью.
- Использовать протекторы для защиты от сред пресной воды.
- Проекторы, выполненные на основе цинка, являются полностью безопасными, их можно применять на пожаро- и взрывоопасных производствах.

Протекторной антикоррозионной защите можно отнести следующий ряд преимуществ:
- недостаток денежных средств и производственных мощностей у предприятия не будет препятствием ее выполнению;
- возможность защиты конструкций небольших размеров;
- если трубы покрыты теплоизоляционными материалами, то такая защита приемлема.
Используемые материалы и цели применения
Противокоррозионная защита необходима для всех металлических оснований. Данный вид противостояния от ржавчины широко используется для обработки танкеров, так как эти суда наиболее подвержены воздействию воды, имеющей в составе агрессивные компоненты. Даже специальная окраска не справляется с решением этой проблемы.
Наиболее рациональным выбором для покрытия стальных конструкций будет использование протекторов с отрицательным потенциалом. При изготовлении таких устройств применяется магний, цинк или алюминий. Большая разница потенциалов металла и стальных поверхностей способствует увеличению спектра защитного действия, в результате различные виды коррозии устраняются.

Пассивная защита требуется стальным покрытиям и изделиям из металла. Сущность метода заключается в применении гальванических анодов, обеспечивающих противодействие подземных трубопроводов коррозии. При произведении расчета для данной установки, необходимо учитывать следующие показатели:
- параметры силы тока;
- сопротивление от перепадов напряжения;
- характеристики степени защиты, применяемые для 1 км трубопровода;
- показатель расстояния между элементами защиты.
Решение задач по химии на покрытие металлов
Задание 284. Если пластинку из чистого цинка опустить в разбавленную кислоту, то начавшееся выделение водорода вскоре почти прекращается. Однако при прикосновении к цинку медной палочкой на последней начинается бурное выделение водорода. Дайте этому объяснение, составив электронные уравнения анодного и катодного процессов. Напишите уравнения протекающей химической реакции.Решение: При опускании пластинки из чистого цинка в раствор разбавленной кислоты, начавшееся выделение водорода вскоре почти прекратится, потому что на пластинке из цинка образуется оксидная плёнка, которая будет препятствовать дальнейшему взаимодействию цинка с разбавленной кислотой. Оксидная плёнка образуется при взаимодействии цинка с кислородом, растворённым в воде по схеме:
Zn + 1/2 O2 = ZnO
Если прикоснуться к цинковой пластинке медной палочкой, то возникнет гальваническая пара цинк — медь, в которой цинк будет являться анодом, а медь – катодом. Это происходит, потому что стандартный электродный потенциал цинка (-0,763 В) значительно отрицательнее, чем потенциал меди (+0,34 В).
Образующиеся ионы Zn2+ будут с имеющимися анионами кислоты давать соль, а ионы водорода Н+, деполяризуясь на медной палочке, Zn – 2 = Zn2+образуют водород, который в виде пузырьков газа выделяется из раствора. Ионно-молекулярное уравнение реакции будет иметь вид:
Молекулярная форма уравнения реакции:
Задание 285. В чем сущность протекторной защиты металлов от коррозии? Приведите пример протекторной защиты железа в электролите, содержащем растворенный кислород. Составьте электронные уравнения анодного и катодного процессов.Решение: Для предотвращения коррозии стальных конструкций применяется протекторная защита: создаётся электрический контакт защищаемой конструкции с протектором – более активным металлом (обычно Zn, Mg, Al или их сплавы). При таком контакте возникает гальваническая пара типа Zn — Fe и коррозии подвергается протектор, а не сама стальная конструкция (трубопровод, корпус корабля и т.п.). Например, корпус корабля защищают протектором – цинковые брусья, которые крепят в нескольких местах днища корабля. Под действием морской воды и кислорода цинк разрушается, а корпус корабля защищается, таким образом, от коррозии. При этом протекают следующие электрохимические процессы:
Анодный процесс: Zn – 2 = Zn2+;Катодный процесс: а) в нейтральной или щелочной среде: 1/2O2 + H2O + 2 = 2OH-; б) в кислой среде: 1/2O2 + 2H+ + 2 = H2O
Таким образом, цинк разрушается, окисляясь до ионов Zn2+, которые с гидроксильными ионами образуют нерастворимый гидроксид Zn(OH)2 или в виде ионов Zn2+ уходит в раствор, если реакция среды кислая. Основной металл остаётся неповреждённым.
Задание 286. Железное изделие покрыли никелем. Какое это покрытие – анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в хлороводородной (соляной) кислоте. Какие продукты коррозии образуются в первом и во втором случаях?Решение: Железо имеет более электроотрицательный стандартный электродный потенциал (-0,44 В), чем никель (-0,24 В), поэтому железо является анодом, никель – катодом.
Анодный процесс – окисление металла: Fe – 2 = Fe2+
и катодный процесс – восстановление ионов водорода (водородная деполяризация) или молекул кислорода (кислородная деполяризация). Поэтому при коррозии пары Fe — Ni с водородной деполяризацией происходит следующие процессы:
Анодный процесс: Fe – 2 = Fe2+ Катодный процесс: в кислой среде: 2Н+ + 2 = Н2
Продуктом коррозии будет газообразный водород соединение железа с кислотным остатком (соль).
При коррозии пары Fe — Ni в атмосферных условиях на катоде происходит кислородная деполяризация, а на аноде – окисление железа:
Анодный процесс: Fe – 2 = Fe2+
Катодный процесс: в нейтральной среде: 1/2O2 + H2O + 2 = 2OH-
Так как ионы Fe2+ с гидроксид-ионами ОН- образуют нерастворимый гидроксид, то продуктом коррозии будет Fe(OH)2. При контакте с кислородом воздуха Fe(OH)2 быстро окисляется до метагидроксида железа FeO(OH), приобретая характерный для него бурый цвет:
4Fe(OH)2 + О2 = 4FeO(OH) + 2Н2О
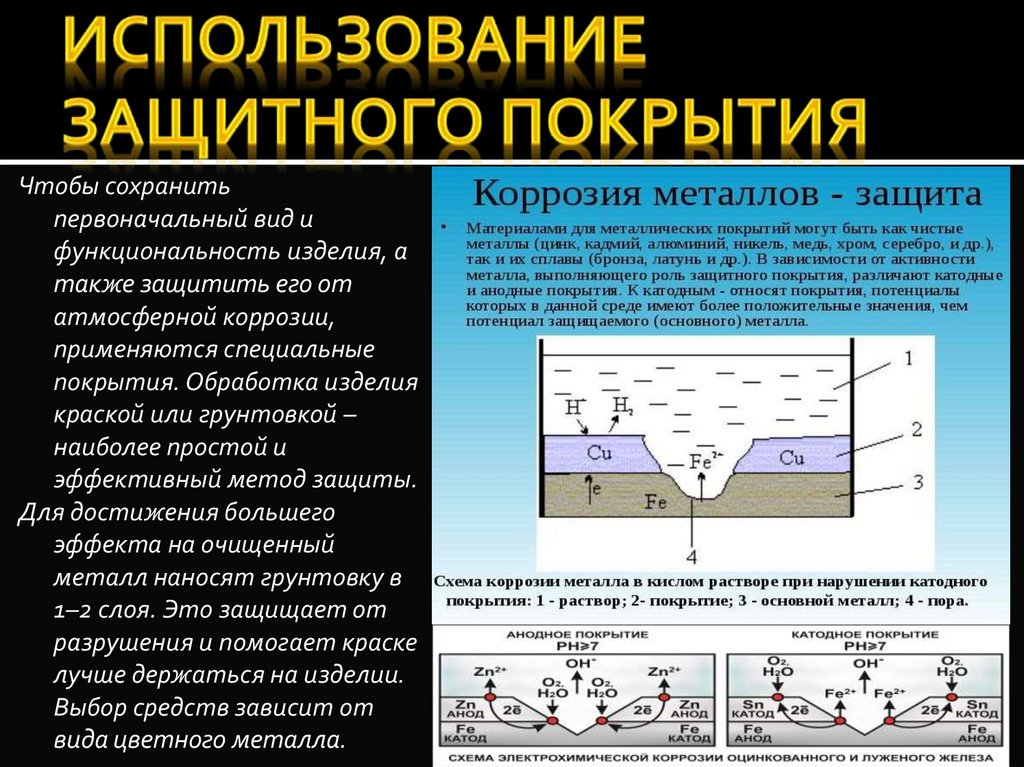
Так как никель имеет более электроположительный стандартный электродный потенциал, чем железо, то данное покрытие является катодным. При повреждении катодного покрытия (или наличия пор) возникает коррозионный элемент, в котором основной материал в поре служит анодом и растворяется, а материал покрытия – катодом, на котором выделяется водород или поглощается кислород. Следовательно, данное катодное покрытие может защищать железо от коррозии лишь при отсутствии пор и повреждений покрытия.
История открытия
Катодная защита была впервые описана сэром Гемфри Дэви в серии докладов, представленных Лондонскому королевскому обществу по развитию знаний о природе в 1824 году. После продолжительных испытаний впервые катодную защиту применили в 1824 г. на судне HMS Samarang. Анодные протекторы из железа были установлены на медную обшивку корпуса судна ниже ватерлинии, что значительно снизило скорость корродирования меди. Медь, корродируя, высвобождает ионы меди, которые обладают антиобрастающим эффектом. В связи с чрезмерным обрастанием корпуса и снижением эффективности корабля Королевский военно-морской флот Великобритании принял решение отказаться от протекторной защиты, чтобы получить преимущества от антифоулингового эффекта вследствие корродирования меди.