Молекулярно-кинетическая теория
Все молекулы состоят из мельчайших частиц – атомов. Все открытые на настоящий момент атомы собраны в таблице Менделеева.
Атом – это мельчайшая, химически неделимая частица вещества, сохраняющая его химические свойства. Атомы соединяются между собой химическими связями. Ранее мы уже рассматривали виды химических связей и их свойства. Обязательно изучите теорию по теме: Типы химических связей, перед тем, как изучать эту статью!
Теперь рассмотрим, как могут соединяться частицы в веществе.
В зависимости от расположения частиц друг относительно друга свойства образуемых ими веществ могут очень сильно различаться. Так, если частицы расположены друг от друга далеко (расстояние между частицами намного больше размеров самих частиц), между собой практически не взаимодействуют, перемещаются в пространстве хаотично и непрерывно, то мы имеем дело с газом.
Если частицы расположены близко друг к другу, но хаотично, больше взаимодействуют между собой, совершают интенсивные колебательные движения в одном положении, но могут перескакивать в другое положение, то это модель строения жидкости.
Если же частицы расположены близко к друг другу, но более упорядоченно, и больше взаимодействуют между собой, а двигаются только в пределах одного положения равновесия, практически не перемещаясь в другие положения, то мы имеем дело с твердым веществом.
Большинство известных химических веществ и смесей могут существовать в твердом, жидком и газообразном состояниях. Самый простой пример – это вода. При нормальных условиях она жидкая, при 0 оС она замерзает – переходит из жидкого состояния в твердое, и при 100 оС закипает – переходит в газовую фазу – водяной пар. При этом многие вещества при нормальных условиях – газы, жидкости или твердые. Например, воздух – смесь азота и кислорода – это газ при нормальных условиях. Но при высоком давлении и низкой температуре азот и кислород конденсируются и переходят в жидкую фазу. Жидкий азот активно используют в промышленности. Иногда выделяют плазму, а также жидкие кристаллы, как отдельные фазы.

Очень многие свойства индивидуальных веществ и смесей объясняются взаимным расположением частиц в пространстве друг относительно друга!
Данная статья рассматривает свойства твердых тел, в зависимости от их строения. Основные физические свойства твердых веществ: температура плавления, электропроводность, теплопроводность, механическая прочность, пластичность и др.
Температура плавления – это такая температура, при которой вещество переходит из твердой фазы в жидкую, и наоборот.

Пластичность – это способность вещества деформироваться без разрушения.

Электропроводность – это способность вещества проводить ток.
Ток – это упорядоченное движение заряженных частиц. Таким образом, ток могут проводить только такие вещества, в которых присутствуют подвижные заряженные частицы. По способности проводить ток вещества делят на проводники и диэлектрики. Проводники – это вещества, которые могут проводить ток (т.е. содержат подвижные заряженные частицы). Диэлектрики – это вещества, которые практически не проводят ток.
В твердом веществе частицы вещества могут располагаться хаотично, либо более упорядоченно. Если частицы твердого вещества расположены в пространстве хаотично, вещество называют аморфным. Примеры аморфных веществ – уголь, слюдяное стекло.

Аморфный бор
Если частицы твердого вещества расположены в пространстве упорядоченно, т.е. образуют повторяющиеся трехмерные геометрические структуры, такое вещество называют кристаллом, а саму структуру – кристаллической решеткой. Большинство известных нам веществ – кристаллы. Сами частицы при этом расположены в узлах кристаллической решетки.
Кристаллические вещества различают, в частности, по типу химической связи между частицами в кристалле – атомные, молекулярные, металлические, ионные; по геометрической форме простейшей ячейки кристаллической решетки – кубическая, гексагональная и др.
В зависимости от типа частиц, образующих кристаллическую решетку, различают атомную, молекулярную, ионную и металлическую кристаллическую структуру.
Точечные дефекты (нульмерные)
Точечные дефекты в кристаллах представляют собой искажения решётки с нулевой размерностью, т.е. ни в какой размерности они не обладают структурой решётки.
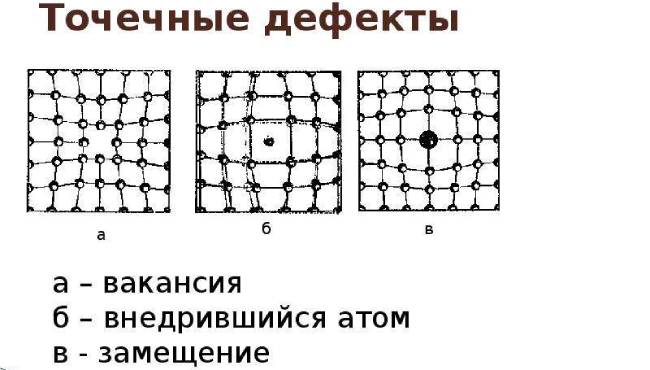
Типичные точечные несовершенства подразделяются на три группы:
-
примесные атомы в чистом металле;
-
вакансии;
-
межузельные атомы.
Вакансии получают путём нагревания в концентрациях, достаточно высоких для количественных исследований. Для получения аналогичных концентраций межузельных атомов точечные искажения можно получить, выполняя внешнюю работу с кристаллом. Такая работа выполняется в атомном масштабе за счет облучения энергоёмкими частицами. Столкновения между посторонними атомами и атомами решётки вызывают смещения последних от мест замещения к местам внедрения. Таким образом, вакансии и междоузлия производятся в равных количествах. Поскольку одна вакансия и одно междоузлие вместе образуют дефект Френкеля, облучение, по сути, является процессом образования такого дефекта. Это невыгодно по сравнению с экспериментальным исследованием межузельных свойств, поскольку радиационно-индуцированные изменения свойств кристаллов всегда включают роль вакансий.
При пластической деформации также образуются вакансии и межузельные частицы. Хотя деформация обходится намного дешевле, чем облучение частицами, метод не стал общепринятой процедурой для создания точечных дефектов, поскольку не позволяет производить контролируемое образование искажений независимо от сложных сетей дислокаций.
Аномально высокие концентрации точечных несовершенств встречаются в некоторых нестехиометрических интерметаллических соединениях. Здесь вакансии и внедрения уже играют роль дополнительных легирующих элементов и имеют в этом смысле термодинамическое значение.
Другие методы получения точечных дефектов – быстрая закалка, испарение на холодных подложках или лазерный отжиг – зависят от термически активированного производства.
В чистых металлах и в большинстве сплавов вакансии обеспечивают термически активированный перенос атомов и, следовательно, свойства вакансий напрямую влияют на перенос атомов. Свойства вакансии дают информацию о межатомных силах с помощью особых возмущений, которые зависят от вакантного узла решётки.
Дефекты в металлах
Выше мы показали идеальную ситуацию, когда все атомы находятся на своих местах, и пространственную структуру всего металлического куска можно получить с помощью простых трансляций элементарной ячейки. В действительности же существуют множество несовершенств кристаллического строения металлов. Они называются дефектами.
Все дефекты можно по геометрическому признаку отнести к одному из четырех типов:
- Точечные. Вакансии, межузельные атомы, наличие внедренных атомов других элементов, создающих микроскопические локальные напряжения.
- Линейные. Дислокации — обрывы кристаллических плоскостей, которые обеспечивают пластичность всех металлов.
- Плоские — границы зерен. Любой металл состоит из множества монокристаллов, которые друг с другом соединены в различной ориентации через межзеренные границы.
- Объемные. Поры, различные фазовые включения, которые упрочняют металл и снижают его пластичность.
Типы кристаллических решеток
Дистанцию соседними атомами называют параметром решетки, у разных металлов он составляет 2 — 6 ангстрем. Существуют три основных типа кристаллических решеток:
- Кубическая: объемно-центрированная — включает в себя девять атомов. Свойственна железу, хрому, молибдену, и ванадию.
- Кубическая гранецентрированная: включает в себя уже 14 атомов. Присуща меди, золоту, свинцу, алюминию.
- Гексагональная: атомов уже 17 и размещены они наиболее плотно. Так кристаллизуются магний, цинк кадмий и другие.
Уникальная возможность железа заключается в том, что до 910°С оно имеет кубическую объемно-центрированную структуру, а при нагреве свыше этой температуры переходит к гранецентрированной.
Реальный кристалл металла
Какой бы химический металлический элемент не рассматривался, в действительности он представляет собой твердое вещество, в котором маленькие монокристаллы (зерна) соединены друг с другом в различных ориентациях. Такая структура образует поликристалл. В нем, помимо границ зерен, присутствуют дефекты всех четырех типов, включая примеси таких неметаллов, как кислород, азот и водород. Последний из-за своих размеров легко проникает в любую кристаллическую решетку, образует с ее ионами твердые фазы, которые приводят к охрупчиванию металла, что является одной из актуальных проблем металловедения.
З. Гексагональная плотноупакованная решетка (ГПУ)
Рис.1.5
В гексагональной плотноупакованной решетке (рис.1.5) атомы расположены в вершинах и в центре шестигранных оснований призмы, а три атома – в средней плоскости призмы. Ячейка ГПУ решетки содержит 17 атомов.
Гексагональную кристаллическую решетку имеют магний, кадмий, цинк и другие металлы.
Некоторые металлы могут изменять тип кристаллической решетки при изменении температуры (при нагреве, либо охлаждении). Такие металлы называются полиморфными.
Явление полиморфизма – изменение типа кристаллической решетки при изменении температуры.
Реальное строение металлов и сплавов
Идеальная кристаллическая решетка представляет собой многократное повторение элементарных кристаллических ячеек. Таких кристаллов в природе практически не существует. Их можно создать только в лабораторных условиях (их называют металлические усы, т.к. их толщина соответствует нескольким межатомным расстояниям).
В реальных кристаллах всегдаприсутствуют дефекты кристаллического строения, которые нарушают периодичность расположения атомов в кристаллической решетке. Эти дефекты оказывают существенное влияние на свойства материалов.
Различают два вида дефектов кристаллического строения: точечные и линейные.
Точечные дефекты характеризуются малыми размерами во всех трех измерениях. Величина их не превышает нескольких атомных диаметров.
К точечным дефектам относятся :
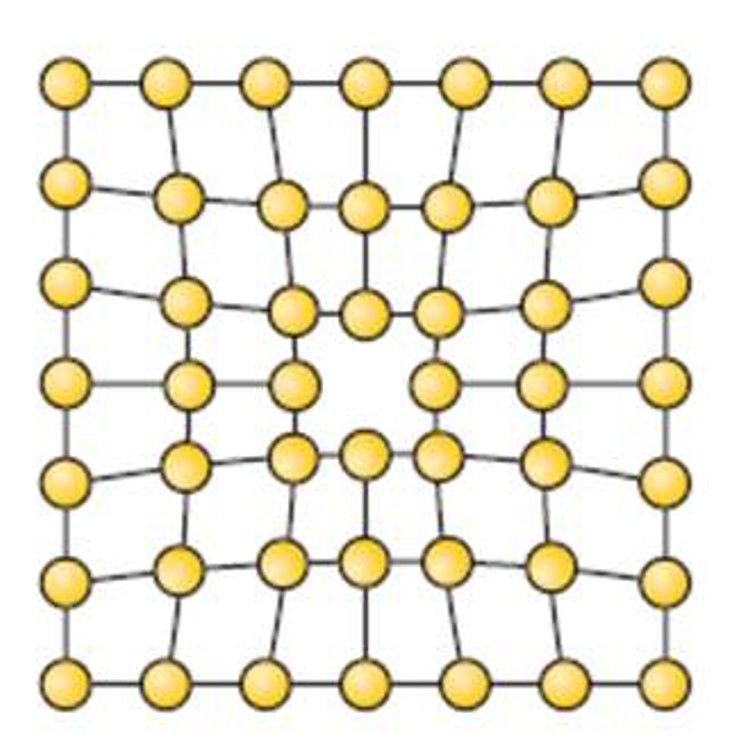
— вакансии ( свободные места в узлах кристаллической решетки (рис.1.6);
— атомы внедрения и замещения (примесные атомы, которые могут находиться и в узлах решетки, и в междоузлии, рис.1.7 а, б)

Рис.1.6. Вакансии
Атомы совершают колебательные движения возле узлов решетки. Под воздействием внешних воздействий (например, температуры) отдельные атомы приобретают энергию, значительно большую, чем средняя энергия соседних атомов в решетке. Эти атомы могут перемещаться из одного места в другое. Наиболее легко перемещаются атомы поверхностного слоя, выходя на поверхность. Место, где находились такие атомы, называется вакансией (рис.1.6). На это место перемещается один из соседних атомов и т.д. Таким образом, вакансия перемещается вглубь кристалла.
При комнатной температуре концентрация вакансий сравнительно невелика и составляет около 1 на 1018 атомов, но количество вакансий в кристаллической решетке резко возрастает при нагреве и может достигать огромных величин. Так, например, в решетке некоторых металлов в 1 см3 количество вакансий может достигать 1013.
К точечным дефектам относят также атомы, внедренные в междоузлие кристаллической решетки (рис.1.7 а) и замещенные атомы, когда место атома основного металла замещается в кристаллической решетке атомом другого элемента (рис.1.7 б).

Рис. 1.7. Примесные атомы внедрения (а) и замещения (б).
Точечные дефекты приводят к локальным искажениям в кристаллической решетке и локальным изменениям межатомных связей. С увеличением количества точечных дефектов может возрастать сопротивление кристаллической решетки дальнейшему смещению атомов.
С другой стороны, присутствие вакансий в решетке объясняет возможность такого физического процесса, как диффузия.
Объемно-центрированная решетка
Строение кристаллической решетки металлов данного типа представляет собой следующую структуру. Это куб, в узлах которого находится восемь атомов. Еще один располагается в центре свободного внутреннего пространства ячейки, что и объясняет название «объемно-центрированная».
Это один из вариантов наиболее простого строения элементарной ячейки, а значит, и всей решетки в целом. Такой тип имеют следующие металлы:
- молибден;
- ванадий;
- хром;
- марганец;
- альфа-железо;
- бетта-железо и другие.
Основные свойства таких представителей — высокая степень ковкости и пластичности, твердость и прочность.
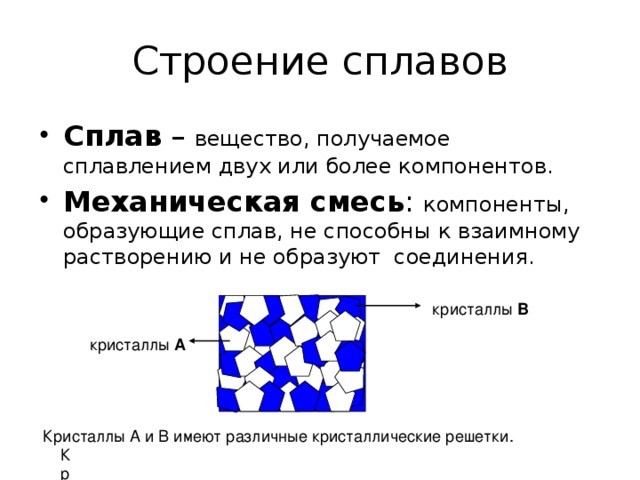
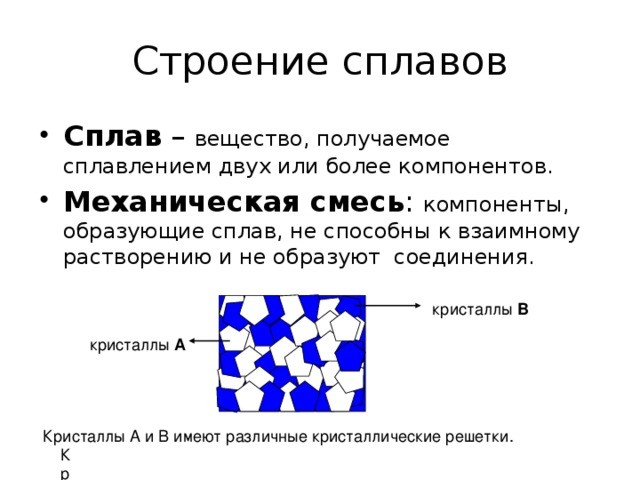
Кристаллическое строение сплавов
Сплав это материал, состоящий из двух и более химических элементов. В его состав могут входить как металлы, так и неметаллы. Например, бронза — это сплав меди и олова, а чугун — сплав железа и углерода. Кроме основных, в состав могут входить и другие вещества, содержащиеся в небольших количествах. Если их добавляют специально и улучшают свойства материала, их называют легирующими присадками, если ухудшают — вредными примесями. Кристаллическое строение сплавов сложнее, чем металлов.
Строение сплавов
Оно определяется взаимовлиянием компонентов при образовании кристалла, и принадлежит к трем подвидам:
- Твердые растворы. Один элемент растворяется в другом. Ведущий элемент строит кристаллическую структуру, а атомы второстепенного элемента размещаются в объеме этой решетки.
- Химическое соединение. Элементы химически реагируют друг с другом, образуя новое соединение. Из его молекул и составляется кристаллическая решетка.
- Механическая смесь. Элементы сплава не реагируют друг с другом. Каждый строит свои кристаллические структуры, срастающиеся в независимые кристаллы. Сплав будет представлять собой затвердевшую смесь из множества кристалликов двух разных типов. Такое вещество будет иметь собственную температуру перехода в жидкую фазу.
Что такое металл и чем он отличается от неметалла?
Иными словами, как можно понять, что перед нами находится металлический материал? Ответы на все эти вопросы можно получить, если рассмотреть уникальные свойства металлов. К ним относятся следующие основные:
- Наличие металлического блеска при полировке поверхности. Все металлы блестят, в своем большинстве они имеют серый цвет, однако, некоторые металлы обладают специфической окраской, например, висмут розовый, медь красноватая, а золото желтое.
- Высокая теплопроводность и электропроводность. При комнатной температуре наиболее высокие показатели для этих физических свойств характерны для меди и серебра.
- При комнатной температуре практически все металлы находятся в твердом агрегатном состоянии материи. Исключение составляет ртуть, которая плавится уже при -39 oC.
- Будучи в твердом состоянии, металлы кристаллическим строением характеризуются. Если расплав рассматриваемого материала слишком быстро охлаждать, то он приобретает аморфную структуру, в которой все же сохраняется ближний порядок.
- Температуры плавления и плотности металлов варьируются в широких пределах. Так, элемент вольфрам является самым тугоплавким (3410 oC). Самым же тяжелым считается осмий (в 22,6 раза плотнее воды), а самым легким – литий (почти в 2 раза менее плотный, чем вода).
- Все металлы химически активны. Поскольку они обладают низкой электроотрицательностью, то в химических реакциях их атомы отдают электроны и превращаются в положительно заряженные ионы (катионы).

Выше в списке были перечислены основные свойства металлов, которые их отличают от неметаллических материалов. Примерами последних являются кислород, азот, благородные газы, сера, кремний, углерод и некоторые другие. Заметим, что все живые организмы состоят в основном из неметаллов.
Металлическая связь
Изучая атомно-кристаллическое строение металлов, следует сказать несколько слов об особенностях химической связи между рассматриваемыми элементами. Поскольку электроотрицательность металлов низкая, то, объединяясь в кристаллическую решетку, каждый атом отдает один или несколько валентных электронов. Эти электроны слабо связаны с ядром, поэтому они легко от него отрываются уже при комнатных температурах.
Совокупность валентных электронов, которые свободно движутся в пространстве между ионными остовами в кристаллической решетке металлов, называется электронным газом. Благодаря ему кусок металла легко проводит тепло и электричество.
Электрическое поле положительно заряженных ионных остовов компенсируется отрицательным полем «размазанного» по объему металла электронного газа. Такая связь называется металлической. Она кардинальным образом отличается от других типов химической связи. Например, в ковалентной атомы не отдают электроны в межатомное пространство, они становятся общими только для двух атомов. Наоборот, в ионной связи один атом полностью лишает второго валентных электронов, присоединяя их к себе, и приобретая отрицательный заряд.
Что такое металл и чем он отличается от неметалла?
Иными словами, как можно понять, что перед нами находится металлический материал? Ответы на все эти вопросы можно получить, если рассмотреть уникальные свойства металлов. К ним относятся следующие основные:
- Наличие металлического блеска при полировке поверхности. Все металлы блестят, в своем большинстве они имеют серый цвет, однако, некоторые металлы обладают специфической окраской, например, висмут розовый, медь красноватая, а золото желтое.
- Высокая теплопроводность и электропроводность. При комнатной температуре наиболее высокие показатели для этих физических свойств характерны для меди и серебра.
- При комнатной температуре практически все металлы находятся в твердом агрегатном состоянии материи. Исключение составляет ртуть, которая плавится уже при -39 oC.
- Будучи в твердом состоянии, металлы кристаллическим строением характеризуются. Если расплав рассматриваемого материала слишком быстро охлаждать, то он приобретает аморфную структуру, в которой все же сохраняется ближний порядок.
- Температуры плавления и плотности металлов варьируются в широких пределах. Так, элемент вольфрам является самым тугоплавким (3410 oC). Самым же тяжелым считается осмий (в 22,6 раза плотнее воды), а самым легким — литий (почти в 2 раза менее плотный, чем вода).
- Все металлы химически активны. Поскольку они обладают низкой электроотрицательностью, то в химических реакциях их атомы отдают электроны и превращаются в положительно заряженные ионы (катионы).

Выше в списке были перечислены основные свойства металлов, которые их отличают от неметаллических материалов. Примерами последних являются кислород, азот, благородные газы, сера, кремний, углерод и некоторые другие. Заметим, что все живые организмы состоят в основном из неметаллов.
Кристаллическое строение сплавов
Сплав это материал, состоящий из двух и более химических элементов. В его состав могут входить как металлы, так и неметаллы. Например, бронза — это сплав меди и олова, а чугун — сплав железа и углерода. Кроме основных, в состав могут входить и другие вещества, содержащиеся в небольших количествах. Если их добавляют специально и улучшают свойства материала, их называют легирующими присадками, если ухудшают — вредными примесями. Кристаллическое строение сплавов сложнее, чем металлов.
Строение сплавов
Оно определяется взаимовлиянием компонентов при образовании кристалла, и принадлежит к трем подвидам:
- Твердые растворы. Один элемент растворяется в другом. Ведущий элемент строит кристаллическую структуру, а атомы второстепенного элемента размещаются в объеме этой решетки.
- Химическое соединение. Элементы химически реагируют друг с другом, образуя новое соединение. Из его молекул и составляется кристаллическая решетка.
- Механическая смесь. Элементы сплава не реагируют друг с другом. Каждый строит свои кристаллические структуры, срастающиеся в независимые кристаллы. Сплав будет представлять собой затвердевшую смесь из множества кристалликов двух разных типов. Такое вещество будет иметь собственную температуру перехода в жидкую фазу.
Металлическая кристаллическая решётка
Из-за наличия в узлах ионов, может показаться, что металлическая решетка похожа на ионную. На самом деле, это две совершенно разные модели, с разными свойствами.
Металлическая гораздо гибче и пластичнее ионной, для неё характерна прочность, высокая электро- и теплопроводность, эти вещества хорошо плавятся и отлично проводят электрический ток. Это объясняется тем, что в узлах находятся положительно заряженные ионы металлов (катионы), которые могут перемещаться по всей структуре, тем самым обеспечивают течение электронов. Частицы хаотично движутся около своего узла (они не имеют достаточной энергии, чтобы выйти за пределы), но как только появляется электрическое поле, электроны образуют поток и устремляются из положительной в отрицательную область.
Металлическая кристаллическая решётка характерна для металлов, например: свинец, натрий, калий, кальций, серебро, железо, цинк, платина и так далее. Помимо прочего, она подразделяется ещё на несколько типов упаковок: гексагональная, объёмно центрированная (наименее плотная) и гранецентрированная. Первая упаковка характерна для цинка, кобальта, магния, вторая для бария, железа, натрия, третья для меди, алюминия и кальция.
Таким образом, от типа решётки зависят многие свойства, а также строение вещества. Зная тип, можно предсказать, к примеру, какой будет тугоплавкость или прочность объекта.
Дефекты в кристаллах
В кристаллах всегда имеются дефекты (несовершенства) строения, обусловленные нарушением правильного расположения атомов кристаллической решетки. Дефекты кристаллического строения подразделяют по геометрическим признакам на точечные, линейные и поверхностные.
Атомы совершают колебательные движения возле узлов решетки, и с повышением температуры амплитуда этих колебаний увеличивается. Большинство атомов данной кристаллической решетки имеют одинаковую (среднюю) энергию и колеблются при данной температуре с одинаковой амплитудой. Однако отдельные атомы обладают энергией, значительно большей средней энергии, и перемещаются из одного места в другое. Наиболее легко перемещаются атомы поверхностного слоя, выходя на поверхность. Место, где находился такой атом, называется вакансией (рис. 2, а). На это место через некоторое время перемещается один из атомов соседнего слоя и т. д. Таким образом вакансия перемещается в глубь кристалла. С повышением температуры количество вакансий увеличивается и они чаще перемещаются из одного узла в другой. В диффузионных процессах, протекающих в металлах, вакансии играют определяющую роль. К точечным дефектам относят также атом, внедренный в междоузлие кристаллической решетки (рис. 2, б), и замещенный атом, когда место атома одного металла замещается в кристаллической решетке другим, чужеродным атомом. Точечные дефекты вызывают местное искажение кристаллической решетки. Линейные дефекты являются другим важнейшим видом несовершенства кристаллической решетки, когда в результате сдвига на одно межатомное расстояние одной части решетки относительно другой вдоль какой-либо плоскости число рядов атомов в верхней части решетки на один больше, чем в нижней. В данном случае в верхней части решетки появилась как бы лишняя атомная плоскость (экстраплоскость). Край экстраплоскости, перпендикулярный направлению сдвига, называется краевой, или линейной, дислокацией (рис. 2, в), длина которой может достигать многих тысяч межатомных расстояний. Шириной дислокации считают расстояние от центра дефекта до места решетки без искажения. Ширина дислокации мала и составляет несколько атомных расстояний.
Кристаллическая решетка в зоне дислокаций упруго искажена, поскольку атомы в этой зоне смещены относительно их равновесного состояния. Для дислокаций характерна их легкая подвижность. Это объясняется тем, что атомы, образующие дислокацию, стремятся переместиться в равновесное состояние. Дислокации образуются в процессе кристаллизации металлов, а также при пластической деформации, термической обработке и других процессах.
Поверхностные дефекты представляют собой границы раздела между отдельными кристаллами (рис. 2, г). На границе раздела атомы кристалла расположены менее правильно, чем в его объеме. Кроме того, по границам раздела скапливаются дислокации и вакансии, а также концентрируются примеси, что еще больше нарушает порядок расположения атомов. При этом сами кристаллы разориентированы, т. е. могут быть повернуты относительно друг друга на десятки градусов. Прочность металла может либо увеличиваться вследствие искажений кристаллической решетки вблизи границ, либо уменьшаться из-за наличия примесей и концентрации дефектов. Дефекты в кристаллах существенно влияют на свойства металлов.
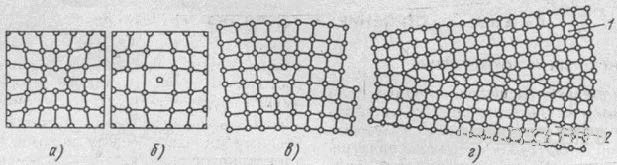
Рис. 2. Дефекты в кристаллах: а – вакансия, б – внедрённый атом, в – краевая линейная дислокация, г – неправильное расположение атомов на границе зерен 1 и 2
Наличие порядка в расположении частиц
В аморфном веществе, в отличие от кристаллического, отсутствует какой-либо порядок в расположении частиц. Если же в кристаллическом веществе мысленно соединить прямой два близкоросположенных друг к другу атома, то можно обнаружить, что на этой линии на строго определенных промежутках будут лежать одни и те же частицы:
Таким образом, в случае кристаллических веществах можно говорить о таком понятии, как кристаллическая решетка.
Кристаллической решеткой называют пространственный каркас, соединяющий точки пространства, в которых находятся частицы, образующие кристалл.
Точки пространства, в которых находятся образующие кристалл частицы, называют узлами кристаллической решетки.
В зависимости от того, какие частицы находятся в узлах кристаллической решетки, различают: молекулярную, атомную, ионную и металлическую кристаллические решетки.
В узлах молекулярной кристаллической решетки Кристаллическая решетка льда Кристаллическая решетка льда как пример молекулярной решетки
находятся молекулы, внутри которых атомы связаны прочными ковалентными связями, однако сами молекулы удерживаются друг возле друга слабыми межмолекулярными силами. Вследствие таких слабых межмолекулярных взаимодействий кристаллы с молекулярной решеткой являются непрочными. Такие вещества от веществ с иными типами строения отличаются существенно более низкими температурами плавления и кипения, не проводят электрический ток, могут как растворяться, так и не растворяться в различных растворителях.
Растворы таких соединений могут как проводить, так и не проводить электрический ток в зависимости от класса соединения. К соединениям с молекулярной кристаллической решеткой относятся многие простые вещества — неметаллы (отвержденные H2, O2, Cl2, ромбическая сера S8, белый фосфор P4), а также многие сложные вещества – водородные соединения неметаллов, кислоты, оксиды неметаллов, большинство органических веществ. Следует отметить, что, если вещество находится в газообразном или жидком состоянии, говорить о молекулярной кристаллической решетке неуместно: корректнее использовать термин — молекулярный тип строения.
кристаллическая решетка алмаза Кристаллическая решетка алмаза как пример атомной решетки В узлах атомной кристаллической решетки
находятся атомы. При этом все узлы такой кристаллической решетки «сшиты» между собой посредством прочных ковалентных связей в единый кристалл. Фактически, такой кристалл является одной гигантской молекулой. Вследствие особенностей строения все вещества с атомной кристаллической решеткой являются твердыми, обладают высокими температурами плавления, химически мало активны, не растворимы ни в воде, ни в органических растворителях, а их расплавы не проводят электрический ток. Следует запомнить, что к веществам с атомным типом строения из простых веществ относятся бор B, углерод C (алмаз и графит), кремний Si, из сложных веществ — диоксид кремния SiO2 (кварц), карбид кремния SiC, нитрид бора BN.
У веществ с ионной кристаллической решеткой в узлах решетки находятся ионы, связанные друг с другом посредством ионных связей.
Поскольку ионные связи достаточно прочны, вещества с ионной решеткой обладают сравнительно высокой твердостью и тугоплавкостью. Чаще всего они растворимы в воде, а их растворы, как и расплавы проводят электрический ток. К веществам с ионным типом кристаллической решетки относятся соли металлов и аммония (NH4+), основания, оксиды металлов. Верным признаком ионного строения вещества является наличие в его составе одновременно атомов типичного металла и неметалла.
Кристаллическая решетка хлорида натрия
Кристаллическая решетка хлорида натрия как пример ионной решетки Однако следует отметить, что в веществах с ионным типом строения нередко можно обнаружить, помимо ионных, также ковалентные полярные связи. Это наблюдается в случае сложных ионов, т.е. состоящих из двух или более химических элементов (SO42-, NH4+, PO43- и т.д.). Внутри таких сложных ионов атомы связаны друг с другом ковалентными связями.
Металлическая кристаллическая решетка
наблюдается в кристаллах свободных металлов, например, натрия Na, железа Fe, магния Mg и т.д. В случае металлической кристаллической решетки, в ее узлах находятся катионы и атомы металлов, между которыми движутся электроны. При этом движущиеся электроны периодически присоединяются к катионам, таким образом нейтрализуя их заряд, а отдельные нейтральные атомы металлов взамен «отпускают» часть своих электронов, превращаясь, в свою очередь, в катионы. Фактически, «свободные» электроны принадлежат не отдельным атомам, а всему кристаллу.
Черные и цветные металлы
Выше была приведена классификация рассматриваемых элементов в соответствии с их электронным строением и положением в периодической системе. Помимо нее, существует еще одно разделение, которое не связано с атомным строением — это понятие о черных и цветных металлах.
Черным является железо и все сплавы с его участием. Примеры цветных металлов — это алюминий, золото, серебро, медь и другие, а также сплавы, которые не содержат железа. Причина такого разделения проста, черные металлы являются дешевыми и недолговечными (разрушаются в результате коррозии, ржавеют). Наоборот, цветные металлы характеризуются способностью образовывать пленки оксидные, которые предотвращают основную массу материала от дальнейшего химического разрушения.
Дефекты кристаллического строения металлов
Однако все рассмотренные типы ячеек могут иметь и естественные недостатки, или так называемые дефекты. Это может быть связано с разными причинами: посторонними атомами и примесями в металлах, внешними воздействиями и прочим.
Поэтому существует классификация, отражающая дефекты, которые могут иметь кристаллические решетки. Химия как наука изучает каждый из них с целью выявления причины и способа устранения, чтобы свойства материала не были изменены. Итак, дефекты следующие.
- Точечные. Они бывают трех основных видов: вакансии, примеси или дислоцированные атомы. Приводят к ухудшению магнитных свойств металла, электро- и теплопроводности его.
- Линейные, или дислокационные. Выделяют краевые и винтовые. Ухудшают прочность и качество материала.
- Поверхностные дефекты. Влияют на внешний вид и структуру металлов.
В настоящее время разработаны методики устранения дефектов и получения чистых кристаллов. Однако совсем искоренить их не удается, идеальной кристаллической решетки не существует.



































