История открытия
Рудокопы Саксонии в XIV-XVI вв. заметили, что после обработки оловянных руд остается много шлака. Работники в здешних копальнях называли его побочным продуктом, который «пожирает» олово, сравнивали с «волком, пожирающим овцу». Так и сформировалось название шлака «wolfrahm» («волчья пена» с немецкого языка).
Когда химик Карл Шееле обработал азотной кислотой «tungsten» («тяжелый камень» в переводе со шведского языка), удалось выделить новый метал, получивший такое же название. Событие произошло в 1781 г. Позже провели ряд анализов, которые показали, что шведскому химику удалось открыть не сам вольфрам, а его оксид. Поэтому минерал переименовали на «шеелит».
Через два года после открытия, сделанного Карлом Шееле, химики из Испании братья Элюар заявили, что смогли выделить из вольфрамита рудников Саксонии чистый вольфрам. Нужно отметить, что ни Шееле, ни братья Элюар не настаивали на том, что именно они стали первооткрывателями вольфрама.
До начала ХХ века химический элемент назывался «tungsten», его обозначали символом «Tu». Термин «вольфрам» и символ «W» был утвержден только в середине прошлого века.
Виды и области применения
Благодаря своим уникальным качествам тугоплавкие металлы очень полезны для различных областей применения и отраслей. Их основные преимущества:
- Сверхвысокая точка плавления. В частности, к тугоплавким металлам относятся вольфрам, молибден и тантал, которые применяются при производстве стекла;
- Прочность при сверхвысоких температурах. Например, конусы ракет, сделанные из вольфрама, имеют вдвое большую прочность на разрыв, чем железо при нормальных температурах;
- Превосходная стойкость к истиранию и износу, что позволяет продлить срок службы седел клапанов, уплотнений, форсунок и других участков, подверженных сильному износу;
- Отличная коррозионная стойкость, поэтому особо ответственные трубопроводы на химических предприятиях обычно изготавливаются из тугоплавких металлов;
- Устойчивость к тепловому удару. В частности, вольфрамовые изделия могут противостоять нагрузкам, вызванным быстрым расширением из-за резких перепадов температуры;
- Тепловая и электрическая проводимость, вследствие чего из вольфрама и молибдена изготавливают детали радиаторов;
- Чрезвычайная твердость, поэтому высокостойкий режущий штамповый и бурильный инструмент производят из карбида вольфрама;
- Высокая плотность тугоплавких металлов – причина их применения при изготовлении головок клюшек для гольфа и авиационных гироскопов.
Кроме того, эти материалы используются в качестве катализаторов химических реакций, при процессах ядерного синтеза и т.д.
К тугоплавким металлам относятся получившие особое распространение вольфрам, молибден, ниобий, тантал, рений и хром. Об особенностях их применения – далее.
Вольфрам
Вольфрам — самый распространенный среди тугоплавких металлов. Он имеет самую высокую температуру плавления и одну из самых высоких плотностей. Обладает также высокой устойчивостью к коррозии. Широко используется в проволочных волокнах, например, в большинстве ламп накаливания, используемых в домах, а также в промышленных дуговых лампах и прочей технике для освещения.
Молибден
Молибден — наиболее используемый тугоплавкий металл из всех, потому что он дешевле, чем большинство других, и, когда он превращен в сплав, может быть очень устойчивым к ползучести и высоким температурам. Он также не образует амальгам, что делает его устойчивым к коррозии.
Молибден используется для упрочнения стальных сплавов, особенно в конструкционных трубопроводах и насосно-компрессорных трубах. Этот металл также обладает отличными антифрикционными качествами, что делает его идеальным компонентом масел и смазок, используемых в автомобилях.
Ниобий
Обладает оптимальным сочетанием пластичности и прочности. Его можно использовать при изготовлении электролитических конденсаторов, сверхпроводников, ядерных реакторов и электронных ламп.
Тантал
Более других устойчив к коррозии, поэтому находит применение в медицине (особенно – хирургии), а также в средах с повышенной кислотностью. Тантал также является основным компонентом компьютерных, телефонных и конденсаторных цепей.
Рений
Известен своей высокой прочностью на разрыв и пластичностью. Он широко используется в ядерных реакторах, гироскопах и других электрических компонентах. Из-за своей редкости рений очень дорог. Понятие коррозионной стойкости особенно актуально именно для рения, потому что он очень летуч. Может терять устойчивость к воздействию кислорода при высоких температурах, поскольку оксидный слой активно испаряется.
Для дополнительного чтения
- Levitin, Valim. High Temperature Strain of Metals and Alloys: Physical Fundamentals. — WILEY-VCH, 2006. — ISBN 978-3-527-31338-9.
- Brunner, T. Chemical and structural analyses of aerosol and fly-ash particles from fixed-bed biomass combustion plants by electron microscopy, 1st World Conference on Biomass for Energy and Industry: proceedings of the conference held in Sevilla, Spain, 5–9 June 2000, London: James & James Ltd (2000). Дата обращения 26 сентября 2010.
- Donald Spink. Reactive Metals. Zirconium, Hafnium, and Titanium // Журнал Industrial & Engineering Chemistry. — 1961. — Вып. 53. — № 2. — С. 97—104. — DOI:10.1021/ie50614a019.
- Earl Hayes. Chromium and Vanadium // Журнал Industrial & Engineering Chemistry. — 1961. — Вып. 53. — № 2. — С. 105—107. — DOI:10.1021/ie50614a020.
Физические свойства металлов
Все металлы обладают следующими общими свойствами:
- Цвет – серебристо-серый с характерным блеском. Исключение составляют: медь и золото. Они соответственно выделяются красноватым и желтым оттенком.
- Агрегатное состояние – твердое тело, кроме ртути, которая является жидкостью.
- Тепло- и электропроводность – для каждого вида металлов выражается по-разному.
- Пластичность и ковкость – изменяющийся параметр в зависимости от конкретного металла.
- Температура плавления и кипения – устанавливает тугоплавкость и легкоплавкость, обладает разными значениями для всех материалов.

Все физические свойства металлов зависят от строения кристаллической решетки, ее формы, прочности и пространственного расположения.
Самый тугоплавкий металл в мире — свойства, получение, применение
Определение «тугоплавкие металлы» не требует дополнительных пояснений в силу исчерпывающей информативности самого термина. Единственным нюансом остается пороговая температура плавления, после которой вещество можно считать тугоплавким.
Где применяется вольфрам?
Широко используют соединения вольфрама. Их применяют в машиностроительной и горнодобывающей промышленностях, для бурения скважин. Из данного металла благодаря его высокой прочности и твердости изготавливают детали двигателей летательных аппаратов, нити накаливания, артиллерийские снаряды, сверхскоростные роторы гироскопов, пули и т.д. Также вольфрам успешно применяется как электрод при аргонно-дуговой сварке. Не обходятся и такие отрасли промышленности без соединений вольфрама – текстильная, лакокрасочная.
Определение
Большинство определений термина тугоплавкие металлы
определяют их как металлы имеющие высокие температуры плавления. По этому определению, необходимо, чтобы металлы имели температуру плавления выше 4,000°F (2,200°C ). Это необходимо для их определения как тугоплавких металлов.
Пять элементов — ниобий, молибден, тантал, вольфрам и рений входят в этот список как основные, в то время как более широкое определение этих металлов позволяет включить в этот список ещё и элементы имеющие температуру плавления 2123 K (1850 °C) — титан, ванадий, хром, цирконий, гафний, рутений и осмий.
Трансурановые элементы (которые находятся за ураном, все изотопы которых нестабильны и на земле их найти очень трудно) никогда не будут относиться к тугоплавким металлам.
Сравнительная таблица степени тугоплавкости чистых металлов
Следует отметить, что тугоплавкие материалы не ограничиваются исключительно металлами. К этой категории относится ряд соединений – сплавы и легированные металлы, разработанных, чтобы улучшить определенные характеристики исходного материала.
Относительно чистых элементов, можно привести наглядную таблицу степени их температурной устойчивости. Возглавляет ее самый тугоплавкий металл, известный на сегодня, – вольфрам с температурой плавления 3422 0С. Такая осторожная формулировка связана с попытками выделить металлы, обладающие порогом расплава, превосходящим вольфрам.
Поэтому вопрос, какой металл самый тугоплавкий, может в будущем получить совсем иное определение.
https://youtube.com/watch?v=d9060b-BaPA
Пороговые величины остальных соединений приведены ниже:
- рений 3186;
- осмий 3027;
- тантал 3014;
- молибден 2623;
- ниобий 2477;
- иридий 2446;
- рутений 2334;
- гафний 2233;
- родий 1964;
- ванадий 1910;
- хром 1907;
- цирконий 1855;
- титан 1668.
Остается добавить еще один интересный факт, касающийся физических свойств жапропрочных элементов. Температура плавления некоторых из них чувствительная к чистоте материала. Ярким примером этому выступает хром, температура плавления которого может варьироваться от 1513 до 1920 0С, в зависимости от химического состава примесей. Поэтому, данные интернет пространства часто разнятся точными цифрами, однако качественная составляющая от этого не страдает.
Хром в чистом виде
Свойства самых тугоплавких металлов
Так самый тугоплавкий металл в мире (вольфрам) обычно легируется рением, торием, никелем при участии меди и/или железа. Первый делает сплав более коррозионстойким, второй — более надежным, а третий — придает небывалую плотность
Следует обратить внимание, что во всех сплавах вольфрама содержится не более 4/5
Из-за того, что вольфрам одновременно и твердый, и тугоплавкий его обычно применяют в электроснабжении, строении приборов, изготовлении оружия, снарядов, боеголовок и ракет. Более плотные сплавы (на базе никеля) применяют для производства клюшек для игры в гольф. Вольфрам образует и так называемые псевдосплавы. Дело в том, что в них металл не легируется, а наполняется жидким серебром или медью.
За счет разницы в температурах расплава получаются лучшие тепло и электропроводные свойства.
Это дает возможность использовать его для изготовления форм для литья цинковых деталей. Особое направления использования молибдена — в качестве легирующего элемента в стальных сплавах. Сплавы сталь+молибден обладают хорошей износостойкостью и невысокими показателями трения.
Сталь+молибден применяют в для изготовления труб, трубных конструкций, автомобиле и машиностроении.
Рекорды для неорганических веществ
Самым сильным стабильным окислителем
, является комплекс дифторида криптона и пентафторида сурьмы. Из-за сильного окисляющего действия (окисляет все элементы в высшие степени окисления, в том числе кислород и азот воздуха) для него очень трудно измерить электродный потенциал. Единственный растворитель, который реагирует с ним достаточно медленно — безводный фтористый водород.
Самым плотным веществом
, является осмий. Его плотность составляет 22,5 г/см 3 .
Самый легкий металл
— это литий. Его плотность составляет 0,543 г/см 3 .
Самый дорогой металл
— это калифорний. Его стоимость в настоящее время составляет 6 500 000 долларов за 1 грамм.
Самый распространенный элемент в земной коре
— это кислород. Его содержание составляет 49% от массы земной коры.
Самый редкий элемент в земной коре
— это астат. Его содержание во всей земной коре, по оценкам специалистов составляет всего 0,16 грамм.
Самым горючим веществом
, является, по-видимому, мелкий порошок циркония. Для того чтоб он не мог гореть, необходимо поместить его в атмосферу инертного газа на пластину из материала, не содержащего неметаллов.
Веществом с наименьшей температурой кипения
, является гелий. Его температура кипения равна -269 градусов по Цельсию. Гелий — единственное вещество, не имеющее температуры плавления при обычном давлении. Даже при абсолютном нуле он остается жидким. Жидкий гелий широко используется в криогенной технике.
Самый тугоплавкий металл
— это вольфрам. Его температура плавления составляет +3420 градусов по Цельсию. Из него изготовляют нити накаливания для электрических лампочек.
Самый тугоплавкий материал
— это сплав карбидов гафния и тантала (1:1). Он имеет температуру плавления +4215 С.
Самым легкоплавким металлом
, является ртуть. Ее температура плавления равна -38,87 градусов по Цельсию. Она же являетсясамой тяжелой жидкостью
, ее плотность составляет 13,54 г/см 3 .
Самую высокую растворимость в воде среди твердых веществ
имеет трихлорид сурьмы. Его растворимость при +25 С составляет 9880 грамм на литр.
Самым легким газом
, является водород. Масса 1 литра составляет всего 0,08988 грамм.
Самым тяжелым газом при комнатной температуре
, является гексафторид вольфрама (т. кип. +17 С). Его масса составляет 12,9 г/л, т.е. в нем могут плавать некоторые виды пенопласта.
Самым стойким к кислотам металлом
, является иридий. До сих пор не известно ни одной кислоты или их смеси, в которых он бы растворялся.
Самый широкий диапазон концентрационных пределов взрываемости
имеет сероуглерод. Взрываться могут все смеси паров сероуглерода с воздухом содержащие от 1 до 50 объемных процентов сероуглерода.
Самой сильной стабильной кислотой
является раствор пентафторида сурьмы во фтористом водороде. В зависимости от концентрации пентафторида сурьмы эта кислота может иметь показатель Гаммета до -40.
Самым необычным анионом в соли
является электрон. Он входит в состав электрида 18-краун-6 комплекса натрия.
Рекорды для органических веществ
Самым горьким веществом
, является денатония сахаринат. Его получили случайно, во время исследования денатония бензоата. Сочетание последнего с натриевой солью сахарина дало вещество в 5 раз более горькое, чем предыдущий рекордсмен (денатония бензоат). В настоящее время оба этих вещества используются для денатурации спирта и других непищевых продуктов.
Самым сильным ядом
, является ботулинический токсин типа А. Его летальная доза для мышей (ЛД50, внутрибрюшинно) составляет 0,000026 мкг/кг веса. Это белок с молекулярной массой 150 000, продуцируемый бактерией Clostridium botulinum.
Самым нетоксичным органическим веществом
, является метан. При увеличении его концентрации интоксикация возникает из-за недостатка кислорода, а не в результате отравления.
Самый тугоплавкий металл на земле
Любознательных людей наверняка интересует вопрос, какой металл самый тугоплавкий? Прежде чем дать на него ответ, стоит разобраться с сами понятием тугоплавкости. Все известные науки металлы имеют разную температуру плавления в связи с различной степенью устойчивости связей между атомами в кристаллической решетке. Чем слабее эта связь, тем меньшая температура требуется, чтобы ее разорвать.
Самые тугоплавкие металлы в мире используются в чистом виде или в составе сплавов для производства деталей, которые работают в экстремальных термических условиях. Они позволяют эффективно противостоять высоким температурам и значительно продляют эксплуатационный период агрегатов. Но стойкость металлов данной группы к термическому воздействию заставляет металлургов прибегать к нестандартным методам их производства.
Какой металл самый тугоплавкий?
Самый тугоплавкий металл на Земле был открыт в 1781 году шведским ученым Карлом Вильгельмом Шееле. Новый материал получил название вольфрам. Шееле удалось синтезировать триокись вольфрама путем растворения руды в азотной кислоте.
Чистый металл был выделен двумя годами позже испанскими химиками Фаусто Фермином и Хуаном Хосе де Элюар. Новый элемент не сразу получил признание и был взят на вооружение промышленниками.
Дело в том, что технологии того времени не позволяли обрабатывать столь тугоплавкое вещество, поэтому большинство современников не придали особого значения научному открытию.
Вольфрам был оценен гораздо позже. На сегодняшний день его сплавы используются при производстве термостойких деталей для различных отраслей промышленности. Нить накаливания в газоразрядных бытовых лампах также изготавливается из вольфрама. Также он применяется в аэрокосмической промышленности для производства ракетных сопел, используется в качестве многоразовых электродов в газодуговой сварке. Кроме тугоплавкости вольфрам также обладает высокой плотностью, что позволяет использовать его для изготовления высококачественных клюшек для гольфа.
Сплавы
Чтобы изменить свойства того или иного металла, его сплавляют с другими веществами. Так, он может не только приобрести большую плотность, прочность, но и снизить или повысить температуру плавления.
Сплав может состоять из двух или больше химических элементов, но хотя бы один из них должен быть металлом. Такие «смеси» очень часто используют в промышленности, ведь они позволяют получить именно те качества материалов, которые необходимы.
Температура плавления металлов и сплавов зависит от чистоты первых, а также от пропорций и состава вторых. Для получения легкоплавких сплавов чаще всего используют свинец, ртуть, таллий, олово, кадмий, индий. Те, в составе которых находится ртуть, называются амальгамами. Соединение натрия, калия и цезия в соотношении 12%/47%/41% становится жидкостью уже при минус 78 °C , амальгама ртути и таллия — при минус 61°C. Самым тугоплавким материалом является сплав тантала и карбидов гафния в пропорциях 1:1 с температурой плавления 4115 °C.
Режущие свойства вольфрама
В 1864 году английский ученый Роберт Мюшет использовал вольфрам как легирующую добавку к стали, которая выдерживала красное каление и еще больше увеличивала твердость. Резцы, которые изготовляли из полученной стали, увеличили скорость резания металла в 1,5 раза, и она стала составлять 7,5 метра в минуту.

Работая в этом направлении, ученые получали все новые технологии, увеличивая скорость обработки металла с использованием вольфрама. В 1907 году появилось новое соединение вольфрама с кобальтом и хромом, которое стало основоположником твердых сплавов, способных увеличивать скорость резания. В настоящее время она возросла до 2000 метров в минуту, и все это благодаря вольфраму – самому тугоплавкому металлу.
Получение тугоплавких материалов
Как отмечалось ранее, основной препятствующий фактор производству жаропрочных металлов их высокая химическая активность, препятствующая выделению элементов в чистом виде.
Основной технологией получения остается порошковая металлургия. Данная методика позволяет получать порошки тугоплавких металлов различными способами:
- Восстановление триоксидом водорода. Процесс производится в несколько этапов, внутри многотрубных печей при 750 – 950 °С. Технология применима под порошки тугоплавких металлов: вольфрам и молибден.
- Восстановлением водородом перрената. Схема реализуется в производстве металлического рения. Рабочие температуры составляют около 500 °С. Заключительная стадия предусматривает отмывание порошка от щелочи. Для этого последовательно используется горячая вода и раствор соляной кислоты.
- Использование солей металлов. Технология развита для выделения молибдена. Основным сырьем выступает аммонийная соль металла и его металлический порошок, вводимый в смесь на уровне 5 – 15% от массы. Состав проходит термическую обработку 500 – 850 °С в проточном инертном газе. Восстановление металла проходит в атмосфере водорода при температурах 800 – 1000 °С.

Производство тугоплавких металлов – порошковая металлургия

Экскурсия на производство
Способы получения жаропрочных металлов продолжают совершенствоваться, как и химическая технология тугоплавких неметаллических и силикатных материалов, что связано с развитием ядерной энергетики, авиастроения, появлением новых моделей ракетных двигателей.
Одно из крупнейших предприятий по производству вольфрама на территории РФ – унечский завод тугоплавких металлов. Этот предприятие относительно молодое, строительство его началось в 2007 году на территории населенного пункта Унеча. Производственный акцент завода направлен на порошки тугоплавких металлов, точнее вольфрама и его карбидов.
В дальнейшем, для получения слитков рассыпчатую массу спекают или сдавливают прессом. Подобным образом порошки тугоплавких металлов обрабатываются для производства жаропрочных изделий.
Разделение металлов
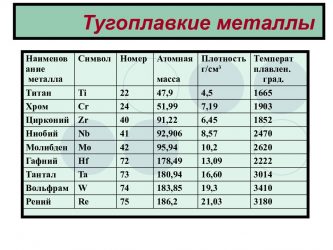
В зависимости от температуры плавления металлы делятся на:
- Легкоплавкие: им необходимо не более 600Со. Это цинк, свинец, виснут, олово.
- Среднеплавкие: температура плавления колеблется от 600Со до 1600Со. Это золото, медь, алюминий, магний, железо, никель и большая половина всех элементов.
- Тугоплавкие: требуется температура свыше 1600Со, чтобы сделать металл жидким. Сюда относятся хром, вольфрам, молибден, титан.
В зависимости от температуры плавления выбирают и плавильный аппарат. Чем выше показатель, тем прочнее он должен быть. Узнать температуру нужного вам элемента можно из таблицы.
Еще одной немаловажной величиной является температура кипения. Это величина, при которой начинается процесс кипения жидкостей, она соответствует температуре насыщенного пара, который образуется над плоской поверхностью кипящей жидкости
Обычно она почти в два раза больше, чем температура плавления.
Обе величины принято приводить при нормальном давлении. Между собой они прямопропорциональны.
- Увеличивается давление – увеличится величина плавления.
- Уменьшается давление – уменьшается величина плавления.
Таблица легкоплавких металлов и сплавов (до 600С о )
| Название элемента | Латинское обозначение | Температуры | |
| Плавления | Кипения | ||
| Олово | Sn | 232 Со | 2600 Со |
| Свинец | Pb | 327 Со | 1750 Со |
| Цинк | Zn | 420 Со | 907 Со |
| Калий | K | 63,6 Со | 759 Со |
| Натрий | Na | 97,8 Со | 883 Со |
| Ртуть | Hg | – 38,9 Со | 356.73 Со |
| Цезий | Cs | 28,4 Со | 667.5 Со |
| Висмут | Bi | 271,4 Со | 1564 Со |
| Палладий | Pd | 327,5 Со | 1749 Со |
| Полоний | Po | 254 Со | 962 Со |
| Кадмий | Cd | 321,07 Со | 767 Со |
| Рубидий | Rb | 39,3 Со | 688 Со |
| Галлий | Ga | 29,76 Со | 2204 Со |
| Индий | In | 156,6 Со | 2072 Со |
| Таллий | Tl | 304 Со | 1473 Со |
| Литий | Li | 18,05 Со | 1342 Со |
Таблица среднеплавких металлов и сплавов (от 600С о до 1600С о )
| Название элемента | Латинское обозначение | Температураы | |
| Плавления | Кипения | ||
| Алюминий | Al | 660 Со | 2519 Со |
| Германий | Ge | 937 Со | 2830 Со |
| Магний | Mg | 650 Со | 1100 Со |
| Серебро | Ag | 960 Со | 2180 Со |
| Золото | Au | 1063 Со | 2660 Со |
| Медь | Cu | 1083 Со | 2580 Со |
| Железо | Fe | 1539 Со | 2900 Со |
| Кремний | Si | 1415 Со | 2350 Со |
| Никель | Ni | 1455 Со | 2913 Со |
| Барий | Ba | 727 Со | 1897 Со |
| Бериллий | Be | 1287 Со | 2471 Со |
| Нептуний | Np | 644 Со | 3901,85 Со |
| Протактиний | Pa | 1572 Со | 4027 Со |
| Плутоний | Pu | 640 Со | 3228 Со |
| Актиний | Ac | 1051 Со | 3198 Со |
| Кальций | Ca | 842 Со | 1484 Со |
| Радий | Ra | 700 Со | 1736,85 Со |
| Кобальт | Co | 1495 Со | 2927 Со |
| Сурьма | Sb | 630,63 Со | 1587 Со |
| Стронций | Sr | 777 Со | 1382 Со |
| Уран | U | 1135 Со | 4131 Со |
| Марганец | Mn | 1246 Со | 2061 Со |
| Константин | 1260 Со | ||
| Дуралюмин | Сплав алюминия, магния, меди и марганца | 650 Со | |
| Инвар | Сплав никеля и железа | 1425 Со | |
| Латунь | Сплав меди и цинка | 1000 Со | |
| Нейзильбер | Сплав меди, цинка и никеля | 1100 Со | |
| Нихром | Сплав никеля, хрома, кремния, железа, марганца и алюминия | 1400 Со | |
| Сталь | Сплав железа и углерода | 1300 Со – 1500 Со | |
| Фехраль | Сплав хрома, железа, алюминия, марганца и кремния | 1460 Со | |
| Чугун | Сплав железа и углерода | 1100 Со – 1300 Со |
Таблица тугоплавких металлов и сплавов (свыше 1600С о )
| Название элемента | Латинское обозначение | Температуры | |
| Плавления | Кипения | ||
| Вольфрам | W | 3420 Со | 5555 Со |
| Титан | Ti | 1680 Со | 3300 Со |
| Иридий | Ir | 2447 Со | 4428 Со |
| Осмий | Os | 3054 Со | 5012 Со |
| Платина | Pt | 1769,3 Со | 3825 Со |
| Рений | Re | 3186 Со | 5596 Со |
| Хром | Cr | 1907 Со | 2671 Со |
| Родий | Rh | 1964 Со | 3695 Со |
| Рутений | Ru | 2334 Со | 4150 Со |
| Гафний | Hf | 2233 Со | 4603 Со |
| Тантал | Ta | 3017 Со | 5458 Со |
| Технеций | Tc | 2157 Со | 4265 Со |
| Торий | Th | 1750 Со | 4788 Со |
| Ванадий | V | 1910 Со | 3407 Со |
| Цирконий | Zr | 1855 Со | 4409 Со |
| Ниобий | Nb | 2477 Со | 4744 Со |
| Молибден | Mo | 2623 Со | 4639 Со |
| Карбиды гафния | 3890 Со | ||
| Карбиды ниобия | 3760 Со | ||
| Карбиды титана | 3150 Со | ||
| Карбиды циркония | 3530 Со |
Вольфрам — самый тугоплавкий металл
Вольфрам — простое химическое вещество, элемент таблицы Менделеева, переходный металл. Записывается в виде латинской буквы W. Название получил от минерала вольфрамит, известного рудокопам с 16-го века. Сам минерал Wolf Rahm (в переводе с немецкого — «волчья пена») получил свое название из-за того, что осложнял получение олова из оловосодержащих пород. При выплавке примеси вольфрама образовывали соединения с оловом и поднимались на поверхность в виде пены; на языке рудокопов «пожирают олово как волк овцу».
Относится к редким элементам, по распространенности на планете занимает 57-е место. Встречается только в минералах, состоящих из соединений разных металлов. В добывающей индустрии наиболее значимы вольфрамит, шеелит, фербелит, гюбнерит. В месторождениях концентрация вольфрама редко превышает 2%.
Как отдельный химический элемент вольфрам был открыт в конце XVIII века. Известный шведский химик К. Шееле проводил эксперименты с минералом тунгстен (позже переименованным в его честь и названным шеелитом). Обработав его азотной кислотой, ученый выяснил, что образец представляет собой соль неизвестной кислоты. Его ученики продолжили работы с интересным минералом и через два года настойчивых исследований выделили неизвестный науке металл, который назвали вольфрамом. Большого шума это открытие не вызвало, т.к. новый металл был чрезвычайно тугоплавким и в мире просто еще не существовало печей, способных обеспечить необходимую температуру для выплавки. Зато в ХХ веке вольфрам произвел в промышленности настоящую революцию.
|
|
|
| Электропечи с максимальной температурой нагрева +1300 °С | Электропечи с максимальной температурой нагрева +1100 °С |
Свойства
Светло-серебристый блестящий металл, напоминающий платину. Очень плотный, тяжелый, твердый, но, при этом, хрупкий. Плавится при t около +3400 °C, это самый высокий показатель среди металлов. (Теоретически более тугоплавким может быть трансактиноид сиборгий, но это короткоживущий радиоактивный элемент №106, получаемый искусственно в результате ядерного синтеза.) В нормальных условиях вольфрам плохо поддается механической обработке, зато при нагреве свыше +1600 °С его можно ковать, прокатывать, вытягивать в тонкую нить. Парамагнетик (может намагничиваться во внешнем магнитном поле), обладает высоким электрическим сопротивлением.
В химических реакциях может проявлять валентность от 2 до 6, но все устойчивые соединения образованы W (VI). При температуре в районе +20 °С не поддается коррозии в воде и на воздухе. Очень слабо реагирует с соляной, фтороводородной и неконцентрированной серной кислотами. А вот с перекисью водорода, азотной кислотой, смесью азотной и фтороводородной кислот, «царской водкой» взаимодействует легко. При высокой t и в присутствии окислителей вступает в реакции со щелочами. Образует оксиды, вольфраматы (соли вольфрамовых кислот), соединения с галогенами, серой, углеродом.
В метаболизме животных и человека не участвует.
Вольфрамовая пыль, как и пыль любого другого металла, оказывает раздражающее влияние на органы дыхания.
Это интересно
На Земле существует несколько типов архебактерий и бактерий, использующих в своих обменных процессах ферменты с вольфрамом. Ученые считают, что они ведут свое развитие с ранней архейской эры (около 4 млрд. лет назад), когда этот металл играл важную роль в создании и развитии жизни на планете.
Вольфрам — крайне востребованный в промышленности металл. Подробнее о его применении мы расскажем в следующей статье.
Ниобий и его сплавы
Nb, или ниобий, — при обычных условиях серебристо-белый блестящий металл. Он также является тугоплавким, поскольку температура перехода в жидкое состояние для него составляет 2477 оС. Именно это качество, а также сочетание низкой химической активности и сверхпроводимости позволяет ниобию становиться все более популярным в практической деятельности человека с каждым годом. Сегодня этот металл используется в таких отраслях, как:
- ракетостроение;
- авиационная и космическая промышленность;
- атомная энергетика;
- химическое аппаратостроение;
- радиотехника.
Этот металл сохраняет свои физические свойства даже при очень низких температурах. Изделия на его основе отличаются коррозионной устойчивостью, жаростойкостью, прочностью, отличной проводимостью.

Этот металл добавляют к алюминиевым материалам для повышения химической стойкости. Из него изготовляют катоды и аноды, им легируют цветные сплавы. Даже монеты в некоторых странах делают с содержанием ниобия.




































