Предостережение
Главный недостаток металла – токсичность. Это также опасный канцероген.
В XIX веке в зоне риска находились модницы: металл был основным компонентом белил для лица.
Сегодня отравиться еще легче:
- Добывая руду.
- Работая на металлургическом комбинате.
- Вдыхая автомобильные выхлопы.
Свинцовые пары и пыль особо опасны: проникают в организм через носоглотку. Из легких свинец переходит в кровь, с ней разносится по телу. Аккумулируется в костях, печени, почках, сбивает синтез гемоглобина в крови.
Признаки свинцового отравления:
- Усталость, быстрая утомляемость.
- Мигрень, головные боли.
- Расстройство ЖКТ.
- Нарушение сна.
Они характерны и для анемии. Опознать свинцовое отравление помогают дополнительные симптомы: судороги, боль в костях, животе, тошнота, рвота. В тяжелых случаях добавляется скачок давления.
Для человека токсичная доза свинца – 1-3 г, смертельная – 10 г
Свинцовое отравление важно сразу распознать, чтобы начать очищение организма. Иначе процесс чреват склерозом сосудов, патологиями костной и нервной систем, почек, печени
У детей может проявиться умственная отсталость.
Выводится металл долго, трудно. Люди, постоянно работающие с ним, нередко наживают профессиональные заболевания.
Отравление соединениями свинца называется сатурнизмом.
Эффекты от воздействия соединений олова
Активность соединений с этим элементом, так или иначе, влияет, как на организм человека, так и на экологию.
На здоровье человека

Эффекты от воздействия этих веществ на человека разнообразны, все зависит от типа соединения и от индивидуальных особенностей организма. Опасность соединения коррелирует с длиной связи между металлом и водородом, чем длиннее эта связь, тем менее опасно соединение. В связи с этим, самым опасным органическим веществом считается соединение олова с тремя этиловыми группами, водородные связи которого являются относительно короткими.
Попасть в организм человека эти вещества могут через еду, воздушно-капельным путем или от простого прикосновения к ним. Известны следующие эффекты воздействия органических соединений олова на организм человека:
- При нахождении в помещении, содержащем пары этого металла, сильное раздражение верхних дыхательных путей, кожных покровов и глаз;
- Головные боли, боли в желудке и отсутствие аппетита;
- Тошнота и рвота;
- Проблемы при мочеиспускании;
- Сильное потоотделение и одышка.
Перечисленные эффекты могут привести к более серьезным последствиям:
- Депрессия;
- Проблемы с печенью;
- Нарушение работы иммунной системы;
- Повреждение хромосом клеток и недостаток красных телец в крови;
- Повреждения мозга (нарушения сна, головные боли, провалы памяти, раздраженное состояние).
На окружающую среду
Известно, что органические оловянные соединения наносят большой вред водным экосистемам, поскольку они являются ядовитыми для грибов, водорослей и фитопланктона
Фитопланктон же является важным звеном водной экосистемы, поскольку он производит кислород для всех остальных живых организмов этой системы, а также является важной частью в пищевой цепи. Токсичность соединений олова различна для разных живых существ, например, трибутиловое олово является ядовитым для рыб и грибов, в то время как самым токсичным соединением для фитопланктона является трифеноловое олово. Также известно, что органические соединения этого элемента оказывают отрицательное влияние на рост и репродуктивную функцию животных, нарушают работу ферментов
Такие соединения накапливаются главным образом в верхних слоях почвы и воды
Также известно, что органические соединения этого элемента оказывают отрицательное влияние на рост и репродуктивную функцию животных, нарушают работу ферментов. Такие соединения накапливаются главным образом в верхних слоях почвы и воды.
Прочность металлов
 Помимо способности перехода из твердого в жидкое состояние, одним из важных свойств материала является его прочность — возможность твердого тела сопротивлению разрушению и необратимым изменениям формы. Основным показателем прочности считается сопротивление возникающее при разрыве заготовки, предварительно отожженной. Понятие прочности не применимо к ртути, поскольку она находится в жидком состоянии. Обозначение прочности принято в МПа — Мега Паскалях.
Помимо способности перехода из твердого в жидкое состояние, одним из важных свойств материала является его прочность — возможность твердого тела сопротивлению разрушению и необратимым изменениям формы. Основным показателем прочности считается сопротивление возникающее при разрыве заготовки, предварительно отожженной. Понятие прочности не применимо к ртути, поскольку она находится в жидком состоянии. Обозначение прочности принято в МПа — Мега Паскалях.
Существуют следующие группы прочности металлов:
- Непрочные. Их сопротивление не превышает 50МПа. К ним относят олово, свинец, мягкощелочные металлы
- Прочные, 50−500МПа. Медь, алюминий, железо, титан. Материалы этой группы являются основой многих конструкционных сплавов.
- Высокопрочные, свыше 500МПа. Например, молибден и вольфрам.
Таблица прочности металлов
| Металл | Сопротивление, МПа |
|---|---|
| Медь | 200−250 |
| Серебро | 150 |
| Олово | 27 |
| Золото | 120 |
| Свинец | 18 |
| Цинк | 120−140 |
| Магний | 120−200 |
| Железо | 200−300 |
| Алюминий | 120 |
| Титан | 580 |
Наиболее распространенные в быту сплавы
 Как видно из таблицы, точки плавления элементов сильно разнятся даже у часто встречающихся в быту материалов.
Как видно из таблицы, точки плавления элементов сильно разнятся даже у часто встречающихся в быту материалов.
Так, минимальная температура плавления у ртути -38,9 °C, поэтому в условиях комнатной температуры она уже в жидком состоянии. Именно этим объясняется то, что бытовые термометры имеют нижнюю отметку в -39 градусов Цельсия: ниже этого показателя ртуть переходит в твердое состояние.
Припои, наиболее распространенные в бытовом применении, имеют в своем составе значительный процент содержания олова, имеющего точку плавления 231.9 °C, поэтому большая часть припоев плавится при рабочей температуре паяльника 250−400°C.
Помимо этого, существуют легкоплавкие припои с более низкой границей расплава, до 30 °C и применяются тогда, когда опасен перегрев спаиваемых материалов. Для этих целей существуют припои с висмутом, и плавка данных материалов лежит в интервале от 29,7 — 120 °C.
Расплавление высокоуглеродистых материалов в зависимости от легирующих компонентов лежит в границах от 1100 до 1500 °C.
Точки плавления металлов и их сплавов находятся в очень широком температурном диапазоне, от очень низких температур (ртуть) до границы в несколько тысяч градусов
Знание этих показателей, а так же других физических свойств очень важно для людей, которые работают в металлургической сфере. Например, знание того, при какой температуре плавится золото и другие металлы пригодятся ювелирам, литейщикам и плавильщикам
Классификация металлов по температуре плавления
В физике переход твердого тела в жидкое состояние характерен только для веществ кристаллической структуры. Температуру плавления металлов чаще обозначают диапазоном значений, для сплавов точно определить нагрев до пограничного фазового состояния сложно. Для чистых элементов каждый градус имеет значение, особенно, если это легкоплавкие элементы,
значения не имеет. Сводная таблица показателей t обычно делится на 3 группы. Помимо легкоплавких элементов, которые максимально нагревают до +600°С, указывают тугоплавкие, выдерживающие нагрев свыше +1600°С, и среднеплавкие. В этой группе сплавы, образующие ванну расплава при температуре от +600 до 1600°С.
Еще одной немаловажной величиной является температура кипения. Это величина, при которой начинается процесс кипения жидкостей, она соответствует температуре насыщенного пара, который образуется над плоской поверхностью кипящей жидкости
Обычно она почти в два раза больше, чем температура плавления.
Обе величины принято приводить при нормальном давлении. Между собой они прямопропорциональны.
- Увеличивается давление — увеличится величина плавления.
- Уменьшается давление — уменьшается величина плавления.
У разных веществ разные температуры плавления. Теоретически, металлы делят на:
- Легкоплавкие – достаточно температуры до 600 градусов Цельсия, для получения жидкого вещества.
- Среднеплавкие – необходима температура от 600 до 1600 ⁰С.
- Тугоплавкие – это металлы, для плавления которых требуется температура выше 1600 ⁰С.
Таблица легкоплавких металлов и сплавов (до 600 Со )
Ниже указана таблица с наименованием легкоплавких металлов и сплавов с температурой плавления до 600 Со.
| Название элемента | Латинское обозначение | Температуры | |
| Плавления | Кипения | ||
| Олово | Sn | 232 Со | 2600 Со |
| Свинец | Pb | 327 Со | 1750 Со |
| Цинк | Zn | 420 Со | 907 Со |
| Калий | K | 63,6 Со | 759 Со |
| Натрий | Na | 97,8 Со | 883 Со |
| Ртуть | Hg | — 38,9 Со | 356.73 Со |
| Цезий | Cs | 28,4 Со | 667.5 Со |
| Висмут | Bi | 271,4 Со | 1564 Со |
| Палладий | Pd | 327,5 Со | 1749 Со |
| Полоний | Po | 254 Со | 962 Со |
| Кадмий | Cd | 321,07 Со | 767 Со |
| Рубидий | Rb | 39,3 Со | 688 Со |
| Галлий | Ga | 29,76 Со | 2204 Со |
| Индий | In | 156,6 Со | 2072 Со |
| Таллий | Tl | 304 Со | 1473 Со |
| Литий | Li | 18,05 Со | 1342 Со |
Таблица среднеплавких металлов и сплавов (от 600С о до 1600Со )
Ниже указана таблица с наименованием среднеплавких металлов и сплавов с температурой плавления от 600 Со от 1600 Со.
| Название элемента | Латинское обозначение | Температураы | |
| Плавления | Кипения | ||
| Алюминий | Al | 660 Со | 2519 Со |
| Германий | Ge | 937 Со | 2830 Со |
| Магний | Mg | 650 Со | 1100 Со |
| Серебро | Ag | 960 Со | 2180 Со |
| Золото | Au | 1063 Со | 2660 Со |
| Медь | Cu | 1083 Со | 2580 Со |
| Железо | Fe | 1539 Со | 2900 Со |
| Кремний | Si | 1415 Со | 2350 Со |
| Никель | Ni | 1455 Со | 2913 Со |
| Барий | Ba | 727 Со | 1897 Со |
| Бериллий | Be | 1287 Со | 2471 Со |
| Нептуний | Np | 644 Со | 3901,85 Со |
| Протактиний | Pa | 1572 Со | 4027 Со |
| Плутоний | Pu | 640 Со | 3228 Со |
| Актиний | Ac | 1051 Со | 3198 Со |
| Кальций | Ca | 842 Со | 1484 Со |
| Радий | Ra | 700 Со | 1736,85 Со |
| Кобальт | Co | 1495 Со | 2927 Со |
| Сурьма | Sb | 630,63 Со | 1587 Со |
| Стронций | Sr | 777 Со | 1382 Со |
| Уран | U | 1135 Со | 4131 Со |
| Марганец | Mn | 1246 Со | 2061 Со |
| Константин | 1260 Со | ||
| Дуралюмин | Сплав алюминия, магния, меди и марганца | 650 Со | |
| Инвар | Сплав никеля и железа | 1425 Со | |
| Латунь | Сплав меди и цинка | 1000 Со | |
| Нейзильбер | Сплав меди, цинка и никеля | 1100 Со | |
| Нихром | Сплав никеля, хрома, кремния, железа, марганца и алюминия | 1400 Со | |
| Сталь | Сплав железа и углерода | 1300 Со — 1500 Со | |
| Фехраль | Сплав хрома, железа, алюминия, марганца и кремния | 1460 Со | |
| Чугун | Сплав железа и углерода | 1100 Со — 1300 Со |
Таблица тугоплавких металлов и сплавов (свыше 1600Со )
Ниже указана таблица с наименованием тугоплавких металлов и сплавов с температурой плавления свыше 1600 Со.
| Название элемента | Латинское обозначение | Температуры | |
| Плавления | Кипения | ||
| Вольфрам | W | 3420 Со | 5555 Со |
| Титан | Ti | 1680 Со | 3300 Со |
| Иридий | Ir | 2447 Со | 4428 Со |
| Осмий | Os | 3054 Со | 5012 Со |
| Платина | Pt | 1769,3 Со | 3825 Со |
| Рений | Re | 3186 Со | 5596 Со |
| Хром | Cr | 1907 Со | 2671 Со |
| Родий | Rh | 1964 Со | 3695 Со |
| Рутений | Ru | 2334 Со | 4150 Со |
| Гафний | Hf | 2233 Со | 4603 Со |
| Тантал | Ta | 3017 Со | 5458 Со |
| Технеций | Tc | 2157 Со | 4265 Со |
| Торий | Th | 1750 Со | 4788 Со |
| Ванадий | V | 1910 Со | 3407 Со |
| Цирконий | Zr | 1855 Со | 4409 Со |
| Ниобий | Nb | 2477 Со | 4744 Со |
| Молибден | Mo | 2623 Со | 4639 Со |
| Карбиды гафния | 3890 Со | ||
| Карбиды ниобия | 3760 Со | ||
| Карбиды титана | 3150 Со | ||
| Карбиды циркония | 3530 Со |
Получение
Как припаять провод без паяльника
Сырьём для извлечения свинца служат породы, включающие геленит. Процесс выплавки тяжёлого металла состоит из нескольких фаз. Из первоначального сырья способом флотации выделяют концентрат с содержанием от 40 до 70 процентов плюмбума. Далее производители идут разными путями.
Одним из способов превращения продукта в веркблей (черновой свинец) является плавка методом регенерации. Другой способ заключается в том, что восстановление металла из оксида происходит плавкой сырья в ватержакетном калорифере.
Полученный веркблей с содержанием 90% свинца очищают от меди. Затем щелочным рафинированием убирают мышьяк и сурьму. Потом выделяют серебро и цинк. Воздействием магния и кальция исключают висмут. В итоге получают свинец чистотой 99,8%.
Производство мирового объёма свинца по итогам исследования международных организаций за 2005 год
| Страна производитель | Объём, килотонн |
| Страны Европы | 2220 |
| КНР | 1430 |
| Российская федерация | 1120 |
| Ю. Корея | 650 |
| Казахстан | 570 |
| Украина | 410 |
Способы плавления свинца
Для промышленной или лабораторной переплавки используют:
- тигли из тугоплавкого и химически инертного металла или керамики, которые помещают в электрическую печь, прогретую до заданной температуры;
- специальные емкости с электрическими обогревателями, поддерживающими равномерную температуру по всему объему.
Оловянно-свинцовые припои
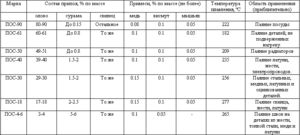
Если предполагается переработать отходы припоев, то температура плавления материала зависит от концентрации олова. Например, ПОС-15 (содержит 15% олова) переходит в жидкую фазу при +280°С, а ПОС-61 или ПОС-63 достаточно прогреть до +183°С. Материалы с добавками сурьмы или кадмия отличаются повышенной механической прочностью, но при плавлении выделяют токсичные пары, негативно воздействующие на здоровье человека. Самостоятельно получить качественный припой невозможно из-за сложностей с точным определением соотношения компонентов в расплаве.

Материалы с добавками сурьмы отличаются повышенной механической прочностью.
Рыболовные лаки
Для защиты отливок от образования оксидной пленки в бытовых условиях используют лаки, предназначенные для обработки рыболовных снастей. Состав наносят кистью, для полимеризации требуется 3-5 минут.
Приготовление расплава и заливка
Краткий алгоритм действий при изготовлении отливок в домашних условиях:
- Измельчить имеющийся лом с помощью кусачек или плоскогубцев, процедура позволяет ускорить процесс плавки. Если предполагается переплавить пластины от аккумулятора, то необходимо удалить из решетки активную массу.
- Поставить емкость на газовую горелку или электрическую печь, включить вытяжку и поместить в резервуар небольшое количество лома. После образования жидкой фазы постепенно уложить в емкость остальные заготовки.
- После разогрева всей массы до жидкого состояния собрать оксидную пленку, плавающую на поверхности, металлической или деревянной ложкой с удлиненной рукояткой.
- Установить на стол форму или тигель, а затем аккуратно вылить расплавленный свинец через направляющий желобок на боковине емкости. Для повышения качества литья рекомендуется предварительно прогреть форму до +150…+200°С в пламени газовой горелки, паяльной лампой или на электрической плите.
- Дождаться кристаллизации и охлаждения формы, а затем аккуратно извлечь отливку. Если на поверхности образовались каверны или металл заполнил не всю форму (например из-за ускоренного охлаждения), то необходимо прогреть тигель от внешнего источника тепла до момента перехода свинца в жидкую фазу (при необходимости потребуется долить расплав).
- Провести механическую обработку (например удалить прилив или излишки, просверлить дополнительные отверстия).
- Нанести слой защитного покрытия (при необходимости). В представленном видео продемонстрирована последовательность шагов при литье заготовок из свинца в бытовых условиях.
Интересное: Что такое поверхностная закалка

После разогрева массы нужно собрать оксидную пленку.
Нахождение в природе
Содержание в земной коре — 1,6·10−3 % по массе. Самородный свинец встречается редко, круг пород, в которых он установлен, достаточно широк: от осадочных пород до ультраосновных интрузивных пород. В этих образованиях он часто образует интерметаллические соединения (например, звягинцевит (Pd,Pt)3(Pb,Sn) и др.) и сплавы с другими элементами (например, (Pb + Sn + Sb)). Он входит в состав 80 различных минералов. Важнейшие из них: галенит PbS, церуссит PbCO3, англезит PbSO4 (сульфат свинца); из более сложных — тиллит PbSnS2 и бетехтинит Pb2(Cu,Fe)21S15, а также сульфосоли свинца — джемсонит FePb4Sn6S14, буланжерит Pb5Sb4S11. Всегда содержится в рудах урана и тория, имея часто радиогенную природу. В природных условиях часто образует крупные залежи свинцово-цинковых или полиметаллических руд стратиформного типа (Холоднинское, Забайкалье), а также скарнового (Дальнегорское (бывшее Тетюхинское), Приморье; Брокен-Хилл в Австралии) типа; галенит часто встречается и в месторождениях других металлов: колчеданно-полиметаллических (Южный и Средний Урал), медно-никелевых (Норильск), урановых (Казахстан), золоторудных и др. Сульфосоли обычно встречаются в низкотемпературных гидротермальных месторождениях с сурьмой, мышьяком, а также в золоторудных месторождениях (Дарасун, Забайкалье). Минералы свинца сульфидного типа имеют гидротермальный генезис, минералы окисного типа часты в корах выветривания (зонах окисления) свинцово-цинковых месторождений. В кларковых концентрациях свинец входит практически во все породы. Единственное место на земле, где в породах больше свинца по сравнению с ураном — Кохистанско-Ладакхская дуга на севере Пакистана.

Галенит, Дальнегорское скарновое месторождение
В таблице приведены некоторые параметры распространённости свинца в природных условиях по А. П. Виноградову:
| Породы | Каменные метеориты | Дуниты и др. | Базальты и др. | Диориты и др. | Граниты и др. | Глины и др. | Земная кора |
| Содержание, масс.% | 0000002×10−5 | 0001×10−5 | 0008×10−4 | 0001,5×10−3 | 0002×10−3 | 0002×10−3 | 1,6×10−3 |
| Объекты | Живое вещество Земли | Литосфера | Почва0 | Растения (в золе) | Вода океанов (мг/л) |
| Содержание, масс.% | 000000005×10−5 | 000,0016 | 00,001 | 000000,001 | 0000000,00003 |
Обобщённые концентрации элементов в минералах приведены в таблице, в скобках — количества минералов, по которым рассчитаны средние содержания компонентов.
| Минерал | Свинец (общ) | Уран | Торий |
| 00Настуран | 04,750 (308) | 58,87 (242) | 2,264 (108) |
| 00Монацит | 00,6134 (143) | 0,2619 (160) | 6,567 (150) |
| 000Ортит | 00,0907 (90) | 0,1154 (88) | 6,197 (88) |
| 000Циркон | 00,0293 (203) | 0,1012 (290) | 0,1471 (194) |
| Сфен (Титанит) | 00,0158 (12) | 0,0511 (14) | 0,0295 (21) |
ПРИМЕНЕНИЕ
 Нитрат свинца применяется для производства мощных смесевых взрывчатых веществ. Азид свинца применяется как наиболее широко употребляемый детонатор (инициирующее взрывчатое вещество). Перхлорат свинца используется для приготовления тяжёлой жидкости (плотность 2,6 г/см³), используемой во флотационном обогащении руд, он иногда применяется в мощных смесевых взрывчатых веществах как окислитель. Фторид свинца самостоятельно, а также совместно с фторидом висмута, меди, серебра применяется в качестве катодного материала в химических источниках тока.
Нитрат свинца применяется для производства мощных смесевых взрывчатых веществ. Азид свинца применяется как наиболее широко употребляемый детонатор (инициирующее взрывчатое вещество). Перхлорат свинца используется для приготовления тяжёлой жидкости (плотность 2,6 г/см³), используемой во флотационном обогащении руд, он иногда применяется в мощных смесевых взрывчатых веществах как окислитель. Фторид свинца самостоятельно, а также совместно с фторидом висмута, меди, серебра применяется в качестве катодного материала в химических источниках тока.
Висмутат свинца, сульфид свинца PbS, иодид свинца применяются в качестве катодного материала в литиевых аккумуляторных батареях. Хлорид свинца PbCl2 в качестве катодного материала в резервных источниках тока. Теллурид свинца PbTe широко применяется в качестве термоэлектрического материала (термо-э.д.с. 350 мкВ/К), самый широкоприменяемый материал в производстве термоэлектрогенераторов и термоэлектрических холодильников. Двуокись свинца PbO2 широко применяется не только в свинцовом аккумуляторе, но и также на её основе производятся многие резервные химические источники тока, например — свинцово-хлорный элемент, свинцово-плавиковый элемент и другие.
Свинцовые белила, основной карбонат Pb(OH)2•PbCO3, плотный белый порошок, — получается из свинца на воздухе под действием углекислого газа и уксусной кислоты. Использование свинцовых белил в качестве красящего пигмента теперь не так распространено, как ранее, из-за их разложения под действием сероводорода H2S. Свинцовые белила применяют также для производства шпатлёвки, в технологии цемента и свинцовокарбонатной бумаги.
Арсенат и арсенит свинца применяют в технологии инсектицидов для уничтожения насекомых — вредителей сельского хозяйства (непарного шелкопряда и хлопкового долгоносика).
Борат свинца Pb(BO2)2•H2O, нерастворимый белый порошок, используют для сушки картин и лаков, а вместе с другими металлами — в качестве покрытий стекла и фарфора.
Хлорид свинца PbCl2, белый кристаллический порошок, растворим в горячей воде, растворах других хлоридов и особенно хлорида аммония NH4Cl. Его применяют для приготовления мазей при обработке опухолей.
Хромат свинца PbCrO4 известен как хромовый жёлтый краситель, является важным пигментом для приготовления красок, для окраски фарфора и тканей. В промышленности хромат применяют в основном в производстве жёлтых пигментов.
Нитрат свинца Pb(NO3)2 — белое кристаллическое вещество, хорошо растворимое в воде. Это вяжущее ограниченного применения. В промышленности его используют в спичечном производстве, крашении и набивке текстиля, окраске рогов и гравировке.
Поскольку свинец хорошо поглощает γ-излучение, он используется для радиационной защиты в рентгеновских установках и в ядерных реакторах. Кроме того, свинец рассматривается в качестве теплоносителя в проектах перспективных ядерных реакторов на быстрых нейтронах.
Значительное применение находят сплавы свинца. Пьютер (сплав олова со свинцом), содержащий 85—90 % Sn и 15—10 % Pb, формуется, недорог и используется в производстве домашней утвари. Припой, содержащий 67 % Pb и 33 % Sn, применяют в электротехнике. Сплавы свинца с сурьмой используют в производстве пуль и типографского шрифта, а сплавы свинца, сурьмы и олова — для фигурного литья и подшипников. Сплавы свинца с сурьмой обычно применяют для оболочек кабелей и пластин электрических аккумуляторов. Было время, когда на оболочки кабелей шла значительная часть производимого в мире свинца, благодаря хорошим влагозащитным свойствам таких изделий. Однако впоследствии свинец в существенной мере вытеснили из этой области алюминий и полимеры. Так, в странах Запада использование свинца на оболочки кабелей упало с 342 тысяч тонн в 1976 году до 51 тысяч тонн в 2002 году. Соединения свинца используются в производстве красителей, красок, инсектицидов, стеклянных изделий и как добавки к бензину в виде тетраэтилсвинца (C2H5)4Pb (умеренно летучая жидкость, пары которой в малых концентрациях имеют сладковатый фруктовый запах, в больших — неприятный запах; Тпл = 130 °C, Ткип = +80 °С/13 мм рт. ст.; плотность 1,650 г/см³; nD2v = 1,5198; не растворяется в воде, смешивается с органическими растворителями; высокотоксичен, легко проникает через кожу; ПДК = 0,005 мг/м³; ЛД50 = 12,7 мг/кг (крысы, перорально)) для повышения октанового числа.
Используется для защиты пациентов от излучения рентгеновских аппаратов.
Свинец (англ. Lead) – Pb
| Молекулярный вес | 207.20 г/моль |
| Происхождение названия | от латинского plumbum |
| IMA статус | действителен, описан впервые до 1959 (до IMA) |
Физико-химические характеристики
Свинец – один из наиболее массивных металлов.

Сизоватость оттенков дополняется металлическим блеском:
- Блеск присущ свежеразрезанным фрагментам: на воздухе он тускнеет, покрываясь оксидом-пленкой.
- Металл мягок (твердость по Моосу – 1,5). Режется ножом или ножницами, царапается ногтем.
- Тепло- и электропроводность средние: у меди больше в 11 и 15 раз.
- Металл пластичен, легко прокатывается до фольги.
По химическим свойствам «простолюдин» свинец спорит с благородными металлами:
- Не ржавеет при любой влажности воздуха. Коррозию провоцирует только фтористый водород.
- Воздействие воды, большинства кислот, металлов, газов нулевое.
- Разрушается лишь некоторыми кислотами: слабой уксусной, азотной (до 70%) либо концентрированной (90+%) серной.
| Свойства атома | |
|---|---|
| Название, символ, номер | Свине́ц / Plumbum (Pb), 82 |
| Атомная масса (молярная масса) |
207,2(1) а. е. м. (г/моль) |
| Электронная конфигурация | 4f14 5d10 6s2 6p2 |
| Радиус атома | 175 пм |
| Химические свойства | |
| Ковалентный радиус | 147 пм |
| Радиус иона | (+4e) 84 (+2e) 120 пм |
| Электроотрицательность | 2,33 (шкала Полинга) |
| Электродный потенциал | Pb←Pb2+ −0,126 В Pb←Pb4+ 0,80 В |
| Степени окисления | 4, 2, 0 |
| Энергия ионизации (первый электрон) |
715,2 (7,41) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 11,3415 г/см³ |
| Температура плавления | 600,61 K (327,46 °C, 621,43 °F) |
| Температура кипения | 2022 K (1749 °C, 3180 °F) |
| Уд. теплота плавления | 4,77 кДж/моль |
| Уд. теплота испарения | 177,8 кДж/моль |
| Молярная теплоёмкость | 26,65 Дж/(K·моль) |
| Молярный объём | 18,3 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая гранецентрированая |
| Параметры решётки | 4,950 Å |
| Температура Дебая | 88,00 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 35,3 Вт/(м·К) |
| Номер CAS | 7439-92-1 |
Металл проявляет интересное оптическое свойство. Отраженный свет придает ему коричневатость, дополняемую буровато-багровым внутренним отражением.
Ниже в таблице данные изменения плотности свинца в зависимости от температуры.
| Температура, °C | Плотность, г/см3 |
|---|---|
| 327,6 | 10,686 |
| 450 | 10,536 |
| 650 | 10,302 |
| 850 | 10,078 |
Исторические сведения
Химический элемент известен людям с древних времён. Одним из первых методов добычи металлов, освоенных человеком, была выплавка свинца. Первыми археологическими находками, подтверждающими это, были найденные свинцовые бусы времён Чатал-Хююк (современная территория Турции). Изделия датируются 6400 годом до нашей эры.
Самая древняя свинцовая фигурка девушки в длинной одежде была выкопана в Египте. Её относят к временам первой династии фараонов (3000 лет до н.э.).
Трубы из свинца составляли древнеримский водопровод. В Древнеримской империи ежегодно выплавляли до 80 тысяч тонн этого металла. На Руси с древних времён свинец использовали как кровельное покрытие соборов и церквей.
Невысокая температура плавления свинца с незапамятных времён сделала доступным получение металла и изготовление из него изделий любой формы.
Обратите внимание! Индустриальная революция с 1840 года в течение 20 лет подняла объём ежегодной выплавки свинца в мире со 100 до 250 тысяч тонн в год
Температура плавления различных металлов
Согласно знаниям из раздела физики, процесс превращения твердого вещества в жидкое имеется лишь у тел с кристаллической решеткой. Температура плавления металлов и сплавов возникает в различном диапазоне значений. Но, с точностью высчитать пограничную температуру фазовых состояний у сплавов весьма проблематично. У чистых элементов имеет значимость каждый градус, если это составы с легкой плавкостью.
Железо
Температура плавления железных составов должна быть высокой. Если элемент обладает технической чистотой, то он плавится при температуре 1 539 °C. В составе его вещества присутствуют включения серы, поэтому для её извлечения необходимо жидкое состояние. Также очищенное железо получается в процессе электролиза солей металла.
Чугун
Чугун считается самым лучшим материалом для плавления. Он имеет хорошие показатели жидкой текучести и усадки, поэтому его эффективно использовать в процессе литья. Ниже будут приведены показатели температурного кипения чугуна:
Серая разновидность чугуна, у которой температурный режим доходит до отметки 1 260 °C. А при разливе его в формы, увеличивается до 1 400 °C.
Белая разновидность чугуна, у которого температура поднимается до 1 350 °C.
Одним из немаловажных моментов является то, что температура, которой обладает чугун, на 400 единиц меньше той же стали. Поэтому процесс обработки данного материала менее энергозатратен.
Сталь, температура плавления
Средняя температура плавления стали составляет 1400 °C.
Сталью называется железосодержащий сплав с включением углерода. Её основной характеристикой является прочность. Это достигается за счет того, что она долгое время сохраняет параметры объема и формы. При этом расположение молекул в веществе находится в сбалансированном состоянии. Именно поэтому достигается равновесие между силой притяжения и силой отталкивания.
Диапазон плавления стали выше, чем у чугуна, поэтому она более энергозатратна.
Нержавеющая сталь
Температура плавления нержавеющей стали колеблется в среднем диапазоне между чугуном и сталью. Нержавеющей сталью называется вещество из легированной стали, обладающее антикоррозийными свойствами за счет содержания хрома в своем составе от 11% процентов и больше.
Показатели температуры плавления нержавейки составляют от 1 300 до 15 000 °C.
Алюминий и медь
Температура плавления алюминия составляет 6 600 °C, поэтому он зарекомендовал себя в качестве одного из среднеплавких металлов. Плавление чистых медных составов происходит при температуре 10 830 °C, а сплавов – 930 — 11 400 °C.
Серебро и золото
Серебро в чистом виде плавится при температуре 9 620 °C. При этом при температуре плавления серебра, оно может сравниться с температурой плавления в градусах со сплавами из меди.
Золото плавится при температуре в 10 640 °C.
Характеристики и особенности свинца
Металл грязно-серебристого или серебристо-синеватого цвета имеет большой удельный вес – 11,34 г/см 3 . Прочность на разрыв не более 18 МПа. на сжатие в пределах 50 МПа. Из-за высокой пластичности поддается многим видам механической обработки, его подвергают холодной прокатке до состояния фольги, штампуют, режут, подвергают нагартовке. При волочении свинец рвется, проволоку из него делают продавливанием заготовок в фильерах.
При охлаждении до -266°С свинец становится сверхпроводником, несмотря на невысокую электропроводность при комнатной температуре (удельное сопротивление 0,22 Ом*мм 2 /м). На воздухе свинец быстро тускнеет на срезе, пассируется, покрывается оксидной пленкой, характеризующейся низкой химической активностью. Сам металл тоже стоек к коррозионным разрушениям, поэтому из свинца и сплавов делают кислотостойкие сосуды, емкости. Pb— последний элемент в периодической таблице Менделеева со стабильными изотопами. Металл способен удерживать радиоактивное излучение.
Кубическая, гранецентрированная структурная решетка обеспечивает вязкость металла, его сложно разломить, но он хорошо режется, его легко исцарапать, смять. При нагревании структура становится текучей, исходная вязкость снижается.
Техника безопасности
Занимаясь плавлением свинца в изолированном помещении, важно позаботиться:
- о вентиляции, необходимо принудительно нагнетать воздух вентилятором, чтобы концентрация горячего аэрозоля была минимальной, свинцовые соединения пагубно влияют на мозг, печень, почки;
- о защите органов дыхания (нужен респиратор), зрения (стоит надеть рабочие очки), одежде с длинным рукавом из натуральных материалов, синтетика при случайном попадании плавится, увеличивается площадь ожога;
- пожарной безопасности, под руками необходимо держать огнетушитель.
Жидкий свинец обладает высокой текучестью. При попадании на влажную поверхность сильно разбрызгивается. Возможны выплески расплава во время нагрева свинцового лома. В рабочей зоне необходимо убрать или изолировать легко возгораемые предметы.

































