Роль бериллия в науке
Бериллий сыграл ключевую роль в развитии теории атома при открытии нейтронов. В начале ХХ века, измеряя атомные массы, физики полагали, что ядра должны содержать не только положительно заряженные протоны. Британский физик сэр Джеймс Чадвик провел десятилетнее исследование в области теории атома и в 1932 г. сообщил, что если бомбардировать бериллий альфа-частицами, испускаемыми радием, то он будет излучать неизвестные субатомные частицы. У этих частиц масса примерно такая же, как и у протона, но они не имеют электрического заряда. Чадвик открыл нейтрон и в 1935 получил за свое открытие Нобелевскую премию в области физики.
Свойства бериллия (таблица): температура, плотность, давление и пр.:
Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения | |
| 101 | Название | Бериллий |
| 102 | Прежнее название | |
| 103 | Латинское название | Beryllium |
| 104 | Английское название | Beryllium |
| 105 | Символ | Be |
| 106 | Атомный номер (номер в таблице) | 4 |
| 107 | Тип | Металл |
| 108 | Группа | Амфотерный, щёлочноземельный металл |
| 109 | Открыт | Луи-Николя Воклен, Франция, 1798 г. |
| 110 | Год открытия | 1798 г. |
| 111 | Внешний вид и пр. | Относительно твёрдый, хрупкий металл светло-серого цвета |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | 2 аллотропные модификации: – α-бериллий с гексагональной плотноупакованной кристаллической решёткой,
– β-бериллий с кубической объёмно-центрированной кристаллической решёткой |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,00019 % |
| 120 | Содержание в морях и океанах (по массе) | 6,0·10-11 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 1,0·10-7 % |
| 122 | Содержание в Солнце (по массе) | 1,0·10-8 % |
| 123 | Содержание в метеоритах (по массе) | 2,9·10-6 % |
| 124 | Содержание в организме человека (по массе) | 4,0·10-8 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 9,012182(3) а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 |
| 203 | Электронная оболочка | K2 L2 M0 N0 O0 P0 Q0 R0 |
| 204 | Радиус атома (вычисленный) | 112 пм |
| 205 | Эмпирический радиус атома | 105 пм |
| 206 | Ковалентный радиус* | 96 пм |
| 207 | Радиус иона (кристаллический) | Be2+ 41 (4) пм,
59 (6) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 153 пм |
| 209 | Электроны, Протоны, Нейтроны | 4 электрона, 4 протона, 5 нейтронов |
| 210 | Семейство (блок) | элемент s-семейства |
| 211 | Период в периодической таблице | 2 |
| 212 | Группа в периодической таблице | 2-ая группа (по старой классификации – главная подгруппа 2-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | +2, +1, 0 |
| 302 | Валентность | II |
| 303 | Электроотрицательность | 1,57 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 899,5 кДж/моль (9,322699(7) эВ) |
| 305 | Электродный потенциал | Be2+ + 2e– → Be, Eo = -1,847 В |
| 306 | Энергия сродства атома к электрону | 0 кДж/моль |
| 400 | Физические свойства | |
| 401 | Плотность* | 1,85 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – кристаллы, твердое тело), 1,690 г/см3 (при температуре плавления 1287 °C и иных стандартных условиях, состояние вещества – жидкость) |
| 402 | Температура плавления* | 1287 °C (1560 K, 2348,6 °F) |
| 403 | Температура кипения* | 2742 K (2469 °C, 4476 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 12,2 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 292 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 1,56 Дж/г·K (при -23 °C), 1,98 Дж/г·K (при 25 °C) |
| 410 | Молярная теплоёмкость* | 16,443 Дж/(K·моль) |
| 411 | Молярный объём | 5,0 см³/моль |
| 412 | Теплопроводность | 200 Вт/(м·К) (при стандартных условиях), 201 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | α-бериллий |
| 512 | Структура решётки | Гексагональная плотноупакованная |
| 513 | Параметры решётки | a = 2,286 Å, c = 3,584 Å |
| 514 | Отношение c/a | 1,567 |
| 515 | Температура Дебая | 1000 K |
| 516 | Название пространственной группы симметрии | P63/mmc |
| 517 | Номер пространственной группы симметрии | 194 |
| 521 | Кристаллическая решётка #2 | β-бериллий |
| 522 | Структура решётки | Кубическая объёмно-центрированная |
| 523 | Параметры решётки | 2,5515 Å |
| 524 | Отношение c/a | |
| 525 | Температура Дебая | |
| 526 | Название пространственной группы симметрии | |
| 527 | Номер пространственной группы симметрии | |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-41-7 |
Примечание:
206* Ковалентный радиус бериллия согласно и составляет 96±3 пм и 90 пм соответственно.
401* Плотность бериллия согласно составляет 1,848 г/см3 (при 0 °C и иных стандартных условиях, состояние вещества – твердое тело).
402* Температура плавления бериллия согласно составляет 1278 °C (1551 K, 2332 °F).
403* Температура кипения бериллия согласно составляет 2970 °C (3243 K, 5378 °F).
407* Удельная теплота плавления (энтальпия плавления ΔHпл) бериллия согласно и составляет 12,21 кДж/моль и 14,7 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) бериллия согласно составляет 309 кДж/моль.
410* Молярная теплоемкость бериллия согласно составляет 16,44 Дж/(K·моль).
Свойства бериллия
Бериллий (Beryllium, в формулах Be) — щелочноземельный металл, в таблице Менделеева имеет атомный № 4.
Характеристики:
- Относится к металлам серебристо-белого цвета.
- Твердый, но хрупкий (тверже, чем другие легкие металлы).
- Высокий модуль упругости.
- Кристаллическая структура решетки гексагональная.
Имеет один стабильный изотоп 9Be.
| Свойства атома | |
|---|---|
| Название, символ, номер | Бери́ллий / Beryllium (Be), 4 |
| Атомная масса (молярная масса) |
9,012182(3) а. е. м. (г/моль) |
| Электронная конфигурация | 2s² |
| Радиус атома | 112 пм |
| Химические свойства | |
| Ковалентный радиус | 90 пм |
| Радиус иона | 35 (+2e) пм |
| Электроотрицательность | 1,57 (шкала Полинга) |
| Электродный потенциал | −1,69 В |
| Степени окисления | +2 ; 0 |
| Энергия ионизации (первый электрон) |
898,8 (9,32) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 1,848 г/см³ |
| Температура плавления | 1551 K (1278 °C, 2332 °F) |
| Температура кипения | 3243 K (2970 °C, 5378 °F) |
| Уд. теплота плавления | 12,21 кДж/моль |
| Уд. теплота испарения | 309 кДж/моль |
| Молярная теплоёмкость | 16,44 Дж/(K·моль) |
| Молярный объём | 5,0 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | гексагональная |
| Параметры решётки | a=2,286 Å; c=3,584 Å |
| Отношение c/a | 1,567 |
| Температура Дебая | 1000 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 201 Вт/(м·К) |
| Номер CAS | 7440-41-7 |
Химические свойства:
- На воздухе покрывается оксидной пленкой.
- Реагирует с разбавленными кислотами; концентрированная HNO3 пассивирует бериллий.
- Не реагирует с водородом даже при нагреве, но легко образует соединения с углеродом, галогенами и серой.
- Проявляет свойства как металлов, так и неметаллов — типичный аморфный металл.
Обладает высокой стойкостью против коррозии.
Месторождения бериллия
Месторождения минералов бериллия присутствуют на территории Бразилии, Аргентины, Африки, Индии, Казахстана, России (Ермаковское месторождение в Бурятии, Малышевское месторождение в Свердловской области, пегматиты восточной и юго-восточной части Мурманской области) и др.
Химические свойства бериллия
Бериллий — сильный восстановитель. Поэтому он реагирует почти со всеми неметаллами:
Бериллий взаимодействует с азотом при 700 — 900º С образуя нитрид бериллия:
3Be + N2 = Be3N2
Бериллий сгорает в кислороде (воздухе) при 900º С с образованием оксида бериллия:
2Be + O2 = 2BeO
Бериллий активно реагирует при комнатной температуре с фтором (комнатная температура), хлором (250º С), бромом (480º С) и йодом (480º С). При этом образуются фторид бериллия, хлорид бериллия, бромид бериллия, йодид бериллия:
Be + F2 = BeF2
Be + Cl2 = BeCl2
Be + Br2 = BeBr2
Be + I2 = BeI2
С серой бериллий реагирует при температуре 1150º C с образованием сульфида бериллия:
Be + S = BeS
С углеродом бериллий реагирует при 1700 — 1900º С и вакууме, образуя карбид бериллия:
2Be + C = Be2C
Бериллий активно взаимодействует со сложными веществами:
Бериллий при кипении реагирует с водой. Взаимодействие бериллия с водой приводит к образованию гидроксида бериллия и газа водорода:
Бериллий взаимодействует с кислотами:
Бериллий реагирует с разбавленной соляной кислотой, при этом образуются хлорид бериллия и водород:
Реагируя с разбавленной и горячей азотной кислотой бериллий образует нитрат бериллия, газ оксид азота (II) и воду:
В результате реакции концентрированной фтороводородной кислоты и бериллия образуется осадок тетрафторобериллат водорода и газ водород:
Бериллий может взаимодействовать с основаниями:
Бериллий взаимодействует с гидроксидом натрия в расплаве при температуре 400 — 500º С, при этом образуется бериллат натрия и водород:
Be + 2NaOH = Na2BeO2 + H2
Бериллий взаимодействует с гидроксидом натрия в растворе, при этом образуется тетрагидроксобериллат натрия и водород:
Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2
Бериллий вступает в реакцию с газом аммиаком при 500 — 700º С. В результате данной реакции образуется нитрид бериллия и водород:
3Be + 2NH3 = Be3N2 + 3H2
Бериллий может вступать в реакцию с оксидами:
В результате взаимодействия бериллия и оксида магния при температуре 1075º С образуется оксид бериллия и магний:
Be + MgO = BeO + Mg
Бериллий взаимодействует с органическими веществами:
Бериллий может вступать в реакцию с ацетиленом при 400 — 450º С, образуя карбид бериллия и водород:
Be + C2H2 = BeC2 + H2
- https://themineral.ru/metally/berillij
- https://chem.ru/berillij.html
- https://chemege.ru/berillij
Бериллий, где используется
Где используется
Две трети бериллия либо соединений забирает промышленность. Каждый сегмент использует нужные для себя достоинства вещества. Самые красивые находки достаются ювелирам и коллекционерам.
Металлургия
Первые в цепочке потребителей руды – металлурги. Добавка микродоз бериллия к сталям и сплавам повышает их утилитарные характеристики: прочность, твердость, невосприимчивость к ржавчине.

Шар из металлического бериллия
Особо популярна бериллиевая бронза (рандоль). Идет на диски, пружины, другие комплектующие, работающие в экстремальных условиях.
Другие отрасли
Продукцию металлургов закупают производители оборудования для разных сфер:
- В ядерной отрасли это отражатель, замедлитель, источник нейтронов (начинка реакторов АЭС). Оксид бериллия плюс уран – ядерное топливо с высоким КПД. Фторид – компонент стекла специального назначения.
- Аэрокосмическая техника. Металл в полтора раза легче алюминия, но прочнее стали. Также жаростоек, упруг, с хорошей теплопроводностью. Поэтому нашел применение как материал корпуса и конструкций ракет, самолетов, космических аппаратов. Недорогой, с пониженной токсичностью гидрид бериллия – основа ракетного топлива.
- Металл неуязвим для рентгеновских лучей, поэтому становится «оконцами» рентгеновских аппаратов, детекторов.
- Это также детали лазеров.
- Металл – третий по теплопроводности среди химических элементов. Используется как огнеупор, изолятор, материал тиглей и специальных сортов керамики.
- Динамики с бериллием – компонент аудиосистем класса люкс.

Оксид бериллия 99,9 % (изделие)
Бериллий — свойства, применения сплавы бериллия |
История открытия бериллия начинается с XVIII столетия, в конце которого французский химик Л. Воклен пытался установить, чем схож по химическому составу ценный минерал бериллия с изумрудом. Из последнего минерала он и выделил оксид элемента BeO. Получить металлический бериллий удалось лишь 30 лет спустя в 1828 году.
Пройдет еще семидесятилетие, прежде чем другой француз – Поль Лебо синтезирует чистые металлические кристаллы вещества посредством электролиза бериллия и двойного фторида калия. Ученый пошел далее, испытав кристаллический порошок на вкус, откуда и пошло изначальное название элемента – глюциний (glykуs – сладкий в переводе с греческого).
Кстати, во Франции наименование бериллий – Be часто сопровождается Glicinium – Gl до сих пор.
Физические свойства бериллия
В свободном состоянии элемент представляет легкий металл серебристо-серого цвета. На воздухе бериллий приобретает матовый оттенок вследствие, быстрого образования поверхностной оксидной пленки.
Строение атома бериллия включает четыре электрона, образующих конфигурацию 1s22s2. Параметры атомного и ионного радиусов Ве составляют 0.113, 0.034 нанометра, соответственно. Порядковый номер элемента в периодической таблице – 4.
Атомная масса бериллия – 9.0122.

Фото бериллий
Элемент характеризуется плотностью 1.816 грамм на сантиметр кубический, и рядом критических температур:
фазового перехода от гексагональной к кубической решетке – 1277 0С.
Бериллий характеризуется наивысшей теплоемкостью, относительно других металлов, хорошей теплопроводностью и низким электрическим сопротивлением.
Химические свойства бериллия
Элемент 2-валентен. Его отличает высокая химическая активность. Устойчивости бериллия на воздухе способствует быстрое окисление: образование прочной поверхностной пленки ВеО, препятствует дальнейшим реакциям.
Дальнейшее быстрое окисление металла происходит при нагревании свыше 800 0С. Взаимодействие металла с водой происходит только после достижения температуры ее кипения. Бериллий растворим в большинстве кислот, исключение составляет только концентрированная азотная.
Также элемент растворяется в водных растворах щелочей, образуя соли бериллия.
Видео – Бериллий. Легкий и дорогой металл:
Взаимодействие Be с другими элементами происходит преимущественно при нагревании. Так, нитрид бериллия образуется при температуре свыше 650 0С в атмосфере азота. Взаимодействие Be с углеродом при 1200 0С и выше переводит металл в карбид бериллия. Более интересно происходит образование гидрида бериллия.
Получение бериллия
Металлический Be получают из одноименного минерала – берилл. Для этого, исходное сырье перерабатывается в гидроксид или сульфат бериллия. В обоих случаях процедура проходит в несколько стадий.
В частности, чтобы получить сульфат бериллия, исходный минерал спекается с известью. Полученное соединение впоследствии обрабатывается серной кислотой.
На заключительной стадии образовавшийся сульфат бериллия выщелачивают водой и осаждают аммиаком.
Видео – Дороже Золота. Первый российский бериллий:
- Фторид бериллия.
- Хлорид бериллия.
В первом случае, полученный фторид бериллия проходит процедуру восстановления магнием при температуре около 1000 0С. Во втором варианте, для выделения чистого металла производится электролиз хлорида бериллия в смеси с NaCl.
Завершающий этап – получение высокочистого металлического Be происходит различными способами:
электронное рафинирование.
Полученный металл измельчают до порошкообразного состояния и прессуют в вакууме при температуре около 1150 0С.
Трубная продукция, прутки и прочие виды профилей металла изготавливаются по технологии горячего и теплого выдавливания, тогда как листовой бериллий производится посредством прокатки. Ковки или волочения.
Риски
Бериллий в виде мелкодисперсного металла в виде растворов, сухого порошка или дыма очень токсичен и может вызвать дерматит. Однако наибольшая токсичность возникает при вдыхании.
Первоначально бериллий может вызывать гиперчувствительность или аллергию, которая может перерасти в бериллиоз или хроническую бериллиевую болезнь (CBD). Это серьезное заболевание, характеризующееся снижением жизненной емкости легких.
Острое заболевание встречается редко. При хроническом заболевании гранулемы образуются по всему телу, особенно в легких. Хронический бериллиоз вызывает прогрессирующую одышку, кашель и общую слабость (астению).
Острый бериллиоз может привести к летальному исходу. При бериллиозе происходит прогрессирующая потеря дыхательной функции, поскольку возникает препятствие потоку газов в дыхательных путях и снижение оксигенации артериальной крови.
Применение Бериллия

Применение бериллия относительно других элементов является не самым распространенным. Практического использования этого химического элемента в быту не очень много. Большая часть приходиится на промышленность и военное дело, причем благодаря своим физическим и химическим свойствам является очень эффективным.
Стоит начать с военного дела. Благодаря свой жесткости, легкого веса и стабильности размеров при широком диапазоне температур, бериллий используется во многих объектах оборонной промышленности. В пример можно поставить корпуса крылатых ракет, высокоскоростных самолетов, космических шатлах. и спутниках. Так же благодаря своей уникальной способности рассеивать тепло, этот металл используется в тормозных дисках для самолетов. Порошок бериллия изначально готовился использоваться как ракетное топливо, но применение так и не состоялось. Очень широкое применение этот элемент находит в точных оптических системах и не только. Бериллий является немагнитным металлом. Этот элемент используют военные для производства инструмента для разминирования.
Что касается бытового применения, то тут можно отметить высокочастотные акустические системы. Так же примеси бериллия можно найти в некоторых полупроводниках и электроизоляторах. Еще отметить необходимо инструмент с примесями бериллия в меди, который является коррозийностойким и прочным. В пример можно привести элементарные разводные ключи. Так же не стоит забывать про ядерную энергетику, в которой бериллий используется для отражения нейтронов.
Читайте: Бруцеллез как заразная инфекция людей и животных
Сплавы на основе бериллия
Подавляющее большинство элементов периодической системы обладают ничтожной растворимостью в бериллии или практически не растворяются в нем. Заметной растворимостью в твердом бериллии при высоких температурах обладают такие элементы, как Co, Ni, Cu, Au, Pd. Однако растворимость этих металлов в бериллии с понижением температуры сильно уменьшается, и появляются выделения вторых фаз, вызывающие охрупчивание бериллия.
Большой интерес представляют сплавы бериллия с 20…40 % алюминия. Эти сплавы отличаются высокими механическими и технологическими свойствами при плотности не намного большей, чем у бериллия. Они обрабатываются значительно легче, чем чистый бериллий. Бериллий образует с алюминием диаграмму состояния эвтектического типа практически без взаимной растворимости (рис. 1). Структура сплавов бериллия с 20…40 % Al представлена хрупкими сравнительно твердыми частицами бериллия и мягкой высокопластичной алюминиевой фазой. Алюминиевая фаза и придает сплавам достаточно высокую технологичность и пластичность. Хотя алюминий и снижает модули упругости бериллия, они остаются достаточно высокими и составляют 220000…250000 МПа при 25…30 % Al, в связи с чем эти сплавы по удельному модулю упругости превосходят все конструкционные материалы. Перспективный для промышленного применения сплав Be + 38 % Al имеет σ в = 385 МПа; σ 0,2 = 300 МПа; δ = 7 %; Е = 189000 МПа. Механические свойства сплавов системы Be – Al могут быть существенно повышены легированием магнием и цинком.
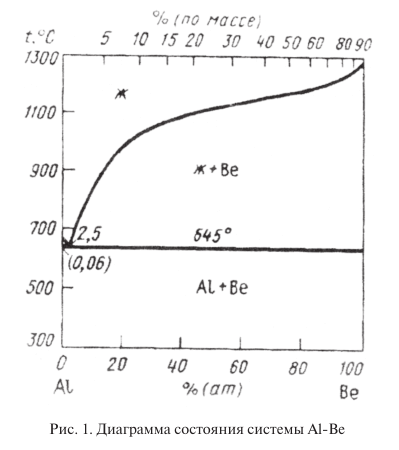
В связи с открытием у бериллия полиморфизма были приняты попытки стабилизировать β-фазу при комнатной температуре. Бериллиевые сплавы со стабилизированной β-фазой благодаря ее кубической структуре должны обладать значительно большей пластичностью по сравнению с α-бериллием и сплавами на основе α-фазы. Фаза β закалкой в воде в бериллиевых сплавах не фиксируется. В системах бериллия с никелем и кобальтом β-фазу удалось зафиксировать лишь сверхбыстрой закалкой при скоростях охлаждения порядка 10 6 град/с. Поэтому в настоящее время стабилизацию β-фазы для получения бериллиевых сплавов считают весьма проблематичной.
Получение
Промышленное производство бериллия началось после того, как в 30-х годах XX века было установлено, что даже малая добавка бериллия к меди резко повышает ее твердость. Эти сплавы, включающие всегда и третий металл, называют бериллиевыми бронзами. Об их применении будет рассказано ниже.
В зависимости от требований к продукту производства — металлическому бериллию, используют различные способы переработки исходного сырья — берилла.
Наибольшие количества бериллия получают в результате процесса, который называют сульфатным. Минерал берилл с серной кислотой (даже с горячей) реагирует очень медленно. Для того чтобы эта реакция проходила быстрее, минерал плавят (1650°С), а затем быстро охлаждают водой. При этом происходит не только затвердевание кусочков берилла, но и их растрескивание, подобно тому как растрескивается толстостенный стакан при наливании в него кипятка. Поверхность соприкосновения минерала с серной кислотой сильно увеличивается, и скорость реакции соответственно возрастает
3ВеО • А12O3 • 6SiO2+6H2SO4= = 3BeSO4+Al2(SO4)3+6SiO2 + 6H2O
После отделения кремнезема из раствора соли алюминия удаляют. Для этого к горячему раствору добавляют сульфат калия или аммония. При охлаждении раствора выпадают кристаллы алюмокалиевых или алюмоаммонийных квасцов KA1(SO4)2, NH4A1(SO4)2. Кристаллы отделяют, добавляют в раствор гидроксид натрия и осаждают гидроксид бериллия Ве(ОН)2, нагревая который получают его оксид. Восстановить оксид бериллия не просто. Связь в молекуле оксида бериллия очень прочная; из доступных восстановителей лишь кальций пригоден для этого процесса. Однако получить чистый бериллий в результате реакции
Са + ВеО = СаО + Ве
не удается, так как образуется устойчивый сплав, состава CaBe3. Поэтому наиболее широко используют метод восстановления не оксида, а фторида бериллия. При взаимодействии оксида бериллия с фтороводородной кислотой образуется фторид бериллия, который затем восстанавливают, сплавляя с магнием:
BeF2+Mg=Be+MgF2
Для получения чистого бериллия, используемого в атомной промышленности, применяют электролиз расплавов солей бериллия.
Технология получения
Бериллиевую руду доставляют на обогатительную фабрику.
Здесь получают соли вещества:
- Из них извлекают металлический продукт, восстанавливая фторид магнием.
- Сырье для второго способа получения – хлориды натрия и бериллия. Смесь расплавляют, затем применяют электролиз.
- Продукт высокой чистоты создают в вакууме переплавкой и дистилляцией.
Переработка руды налажена в США, КНР, Казахстане, России.
Обработка бериллия проблематична, опасна для здоровья, поэтому главные способы производства – точное литье и порошковая металлургия. Размолотый металл спрессовывают, создавая форму по заданным параметрам либо универсальную заготовку (труба, пруток).
Обработку затрудняет хрупкость. Этот недостаток устранили в 1970-х годах, выяснив, что пластичен чистый бериллий.
Получение бериллия
Металлический Be получают из одноименного минерала – берилл. Для этого, исходное сырье перерабатывается в гидроксид или сульфат бериллия. В обоих случаях процедура проходит в несколько стадий. В частности, чтобы получить сульфат бериллия, исходный минерал спекается с известью. Полученное соединение впоследствии обрабатывается серной кислотой. На заключительной стадии образовавшийся сульфат бериллия выщелачивают водой и осаждают аммиаком.
Видео – Дороже Золота. Первый российский бериллий:
Альтернативные способы получения чистой формы металла, предусматривают вскрытие берилла, с последующей обработкой состава двумя способами, чтобы получить:
- Фторид бериллия.
- Хлорид бериллия.
В первом случае, полученный фторид бериллия проходит процедуру восстановления магнием при температуре около 1000 0С. Во втором варианте, для выделения чистого металла производится электролиз хлорида бериллия в смеси с NaCl.
Завершающий этап – получение высокочистого металлического Be происходит различными способами:
дистилляция в вакууме;
зонная плавка;
электронное рафинирование.
Полученный металл измельчают до порошкообразного состояния и прессуют в вакууме при температуре около 1150 0С.
Трубная продукция, прутки и прочие виды профилей металла изготавливаются по технологии горячего и теплого выдавливания, тогда как листовой бериллий производится посредством прокатки. Ковки или волочения.
Бериллий — металл с удивительными свойствами
Бериллий — простое вещество, элемент таблицы Менделеева с номером 4, металл. Обозначается латинскими буквами Be (Beryllium). Название получил по имени минерала берилла, из которого его и получили.
Открыт новый элемент был в середине 18-го века во Франции Луи Вокленом, который исследовал, чем состав берилла отличаются от изумруда. Сам металл он выделить не смог, но получил оксид бериллия, установил существование неизвестного ранее металла, который предложил назвать глюцинием, от греческого слова glykуs («сладкий»). Такое название он объяснял тем, что соединения бериллия сладкие на вкус. Во Франции и сейчас этот элемент часто называют глюцинием и обозначают Gl.
Химически чистый металл был получен лишь спустя 100 лет французом Полем Лебо с помощью электролиза. Металлический порошок тоже оказался на вкус сладким.
Бериллий считается редким металлом, мировые запасы оцениваются всего в 80 тыс. тонн. Содержится преимущественно на суше, в морях и океанах его почти нет. Существует более 30-ти минералов, в состав которых входит бериллий, но практически все они очень редкие. Только берилл, хризоберилл, бертрандит, гельвин, даналит, фенакит встречаются относительно часто. Промышленно значимым является только берилл.
| Маска полнолицевая ЗМ 6800 средний размер | Костюм «Л-1» с хранением |
Свойства
Серебристый металл с масляным блеском. На воздухе за пару часов покрывается серой пленкой окиси. Отличается высокой твердостью и хрупкостью, что значительно осложняет его обработку. Очень легкий (легче алюминия) и прочный (проволока толщиной 1 мм выдерживает вес около 80 кг, подобная алюминиевая проволока — только 12 кг). При нагреве свыше +400 °С теряет лишь 50% прочности (для сравнения, дюралюминий — 80%). Обладает более высокой упругостью, чем стали, причем упругость сохраняется даже при высоких температурах. Еще одно замечательное качество — в нем почти не накапливается усталость металла. У Be аномально высокие температуры кипения и плавления. Теоретически он должен плавиться при t не более +400 °С, на деле — при +1278 °С. Отличается высокой теплоемкостью, теплопроводностью, низким электросопротивлением.
В обычных условиях химически малоактивен, это объясняется строением атомного ядра с электронами на s-орбиталях. Нужны экстремальные условия или очень активные вещества, чтобы отобрать электроны с этих орбиталей. Дополнительную защиту дает тончайшая пленка оксида, образующаяся на поверхности. Поэтому в химические реакции бериллий вступает, большей частью, после сильного нагревания. Основная валентность — два.
Химически сходен с алюминием. В нормальных условиях взаимодействует с разбавленными щелочами и минеральными кислотами (кроме концентрированной азотной). Кристаллы устойчивы к воздействию воды даже при сильном нагревании. Порошкообразное вещество горит, одновременно реагируя с кислородом и азотом воздуха, образуя окись и нитрид. Реагирует с галогенами, халькогенами (группа кислорода, серы и селена), аммиаком, углеродом, но при нагревании до 600-1200 °С и выше. Ни при каких условиях напрямую не взаимодействует с водородом.
Меры предосторожности
Крайне токсичен. В микродозах распространен по всей земной коре, присутствует в растениях, организме животных и человека. Человек получает его с пищей — это безвредно.
Опасность представляет пыль Be и его производных, образующаяся в процессах обработки. Попав в организм, бериллий встраивается в некоторые ферменты и кости вместо магния, нарушая работу всего организма. Регулярное вдыхание бериллиевой пыли вызывает сухой кашель и отек легких (бериллиоз), которые могут даже привести к смерти. Кроме этого, металл обладает аллергическим и канцерогенным действием.
Стихи про бериллий
Друг-геолог говорил,Что нашел в горах берилл,Что среди невзрачных рудЯрко вспыхнул изумруд!
А ещё он говорил,Что нашел аквамаринПрямо в самородной жиле.Мне приятель объяснил:– В тех камнях живет Бериллий(От названия «берилл»).
Мы Бериллию металлуНе поставим много баллов:Сам Бериллий скромен, прост,Тускло–серенького цвета,Но сверкают ярче звёздИзумруды-самоцветы!
*****
Переходный он металл,Первый в своем роде.Хрупким он довольно стал,Но довольно прочным.
С кислородом он всегдаОксиды образует.Пленка оксида всегдаЕго преобразует.
Мало где он применим:Топливо, ракеты.И в рентген незаменим,И другие цели.
Серый цвет, оттенок светлый.Радиус широкий.Степень окисления в нем+1 да двойный.
В изумрудах оный есть.В аквамарине тоже.В минералах место быть.В воде соленой тоже.
Напоследок я скажуТолько 2 детали:Не вдыхайте его пару,И любите магний!
*****
Лежали на солнце, попали под ливень —И сразу стемнело на Финском заливе.Все стало так ново и так непривычно,Когда неожиданно вспыхнула спичка —И падает мир, ослепленный этим событием.Я не живу, я слежу за собственной жизни развитием.
Представь себе — в трех переулках отсюда,Над лавкой, в которой ножи и посуда,В квартире, в которой легко заблудитьсяКакой-то старик спит и видит таблицу,И в этой таблице я между бором и литием.Я не живу, я слежу за собственной жизни развитием.
Мы сходим с ума в одиночку и группамиНовости кормят нас свежими трупамиКакими мы были смешными и глупыми
Мне хочется, хочется — это так просто —Взять и сбежать на затерянный остров,И при свете Луны, под кокосовой пальмойСидеть и читать дневники Лоры Палмер.И в тех дневниках нет ни слова о том, что нам выпадет.Жена ждет пилота из аэропорта на выходе.
Неспешно в стихи заплетаются строчки,По карте блуждают горячие точки,Все двери открыты, распахнуты окна,Зима обещает быть очень жестокой.В табачном дыму, за спиртных напитков распитиемЯ не живу, я слежу за собственной жизни развитием.
Свойства и характеристики бериллия
Бериллий имеет уникальные свойства, которые выделяют его среди других металлов. От них зависят сферы применения материала.
Физические свойства бериллия
Выглядит бериллий как светло-серый металл. Он относительно твердый, по шкале Мооса оценен в 5,5 баллов. Это значит, что его можно повредить лишь с усилием, и только чем-то острым. Он является одним из самых твердых металлов, существующих в чистом виде. По данному показателю его опережает иридий, осмий, вольфрам и уран.
Можно выделить следующие физические характеристики:
- Плотность – 1,848 г/см³.
- Молярный объем – 5,0 см³/моль.
- Температура плавления и кипения – 1278 °C и 2970 °C соответственно.
- Молярная теплоемкость – 16,44 Дж/(K•моль).
- Удельная теплота плавления и испарения – 12,21 и 309 кДж/моль соответственно.
Еще у этого металла высокий модуль упругости, составляющий 300 Гпа. Даже у сталей этот показатель равен 200-210 Гпа. Находясь на воздухе, он активно покрывается стойкой пленкой атмосферного оксида ВеО. Также стоит отметить, что в бериллии
Химические свойства бериллия
Химические свойства металла бериллия:
- Валентность — 2.
- Реагирует с галогенами при высоких температурах.
- Не вступает в реакции с водородом.
- Взаимодействует с щелочами, кислотами.
Механические свойства бериллия
Механические свойства бериллия зависят от наличия сторонних примесей, легирующих добавок, методов обработки, которые применялись при его получении, величины зерен.
Свойства:
- Максимальный предел прочности на вытяжку — 400–800Мн/м2.
- Предел текучести — 250–600 Мн/м2.
- Относительное удлинение — до 12%.
Атом и молекула бериллия. Формула бериллия. Строение атома бериллия:
Бериллий (лат. Beryllium, от названия минерала берилла) – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Be и атомным номером 4. Расположен в 2-й группе (по старой классификации – главной подгруппе второй группы), втором периоде периодической системы.
Бериллий – амфотерный, щёлочноземельный металл.
Бериллий обозначается символом Be.
Как простое вещество бериллий при нормальных условиях представляет собой относительно твёрдый, хрупкий металл светло-серого цвета.
Молекула бериллия одноатомна.
Химическая формула бериллия Be.
Электронная конфигурация атома бериллия 1s2 2s2. Потенциал ионизации (первый электрон) атома бериллия равен 899,5 кДж/моль (9,322699(7) эВ).
Строение атома бериллия. Атом бериллия состоит из положительно заряженного ядра (+4), вокруг которого по двум оболочкам движутся 4 электрона. При этом 2 электрона находятся на внутреннем уровне, а 2 электрона – на внешнем. Поскольку бериллий расположен во втором периоде, оболочек всего две. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внешняя оболочка также представлена s-орбиталью. На внешнем энергетическом уровне атома бериллия – на 2s-орбитали находятся два спаренных электрона. В свою очередь ядро атома бериллия состоит из 4 протонов и 5 нейтронов. Бериллий относится к элементам s-семейства.
Радиус атома бериллия (вычисленный) составляет 112 пм.
Атомная масса атома бериллия составляет 9,012182(3) а. е. м.































