История
Уильям Хайд Волластон
Уильям Хайд Волластон отметил открытие нового благородного металла в июле 1802 года в своей лабораторной книге и назвал его палладием в августе того же года. Волластон очистил некоторое количество материала и предложил его, не называя первооткрывателя, в небольшом магазине в Сохо в апреле 1803 года. После резкой критики Ричарда Ченевикса за то, что палладий представляет собой сплав платины и ртути, Волластон анонимно предложил вознаграждение в размере 20 фунтов стерлингов. на 20 зерен синтетического сплава палладия . Ченевикс получил медаль Копли в 1803 году после публикации своих экспериментов с палладием. Волластон опубликовал открытие родия в 1804 году и упоминает некоторые из своих работ по палладию. Он сообщил, что он был первооткрывателем палладия в публикации 1805 года.
Он был назван Волластоном в 1802 году в честь астероида 2 Паллада , открытого двумя месяцами ранее. Уолластон найдено палладия в сырой платиновой руды из Южной Америки путем растворения руды в царской водке , нейтрализации раствора гидроксида натрия , и осаждении платины , как хлороплатинат аммония с хлоридом аммония . Он добавил цианид ртути с образованием цианида палладия (II) , который нагревали для извлечения металлического палладия.
Одно время для лечения туберкулеза назначали хлорид палладия из расчета 0,065 г в день (примерно один миллиграмм на килограмм массы тела). Это лечение имело множество отрицательных побочных эффектов , и позже было заменено более эффективными лекарствами.
Чаще всего палладий используется в каталитических нейтрализаторах в автомобильной промышленности. В период до 2000 г. поставки палладия из России на мировой рынок неоднократно задерживались и прерывались; по политическим причинам экспортная квота не была предоставлена вовремя. Последовавшая паника на рынке привела к тому, что в январе 2001 года цена достигла рекордного уровня в 1340 долларов за тройскую унцию (43 доллара за г ). Примерно в то же время Ford Motor Company , опасаясь, что производство автомобилей будет остановлено из-за нехватки палладия, создала запасы металл. Когда в начале 2001 года цены упали, Ford потерял почти 1 миллиард долларов США.
Мировой спрос на палладий увеличился со 100 тонн в 1990 году до почти 300 тонн в 2000 году. По данным Геологической службы США, мировое производство палладия на рудниках в 2006 году составило 222 тонны . Многие были обеспокоены стабильными поставками палладия после аннексии Крыма Россией , отчасти потому, что санкции могут помешать российскому экспорту палладия; любые ограничения на экспорт палладия из России могли усугубить уже ожидавшийся большой дефицит палладия в 2014 году. Эти опасения подняли цены на палладий до самого высокого уровня с 2001 года. В сентябре 2014 года они превысили отметку в 900 долларов за унцию. Однако в 2016 году палладий стоил около 614 долларов за унцию, поскольку России удалось сохранить стабильные поставки. В январе 2019 года фьючерсы на палладий впервые в истории превысили 1344 доллара за унцию, в основном из-за высокого спроса со стороны автомобильной промышленности. 6 января 2020 года цена на палладий достигла 2024,64 доллара за тройскую унцию (65,094 доллара за г), впервые превысив отметку в 2000 долларов за тройскую унцию.
Нахождение в природных условиях
По объему содержания в земной коре этот драгоценный металл входит в число самых редких элементов. В природе его можно встретить в виде:
- самородка (аллопалладий);
- минералов интерметаллического типа (станнопалладинит, палладистая платина и т. д. );
- различных соединений (брэггит, палладинит и т. д. ).
Известных науке разновидностей минералов палладия насчитывается около трех десятков. Этот элемент нередко выступает в качестве сопровождающего другие платиновые металлы. Содержание вещества в платиноидной смеси колеблется в диапазоне 25−60% (в зависимости от месторождения).
Самородный палладий встречается крайне редко. По своему внешнему виду он почти неотличим от платины. В самородках, помимо палладия, содержатся и другие элементы:
- иридий;
- золото;
- платина;
- серебро.
Согласно геохимической классификации элементов Гольдшмидта, палладий (наряду со всеми другими платиноидами) входит в число сидерофилов. Иначе говоря, он имеет характерное сродство к железу и сконцентрирован в земном ядре.
Платину и палладий добывают на месторождениях двух типов:
- россыпных;
- коренных.
Отличие этих разновидностей друг от друга заключается в способе выработки. В месторождениях коренного типа металл содержится в минералах. В таких местах добыча вещества осуществляется путем обработки руд — медных или никелевых. Палладий извлекается в качестве побочного продукта.
Месторождения россыпного типа — это бывшие коренные залежи руд. Они уже выработаны, палладий освобожден и принял форму самородков.
На долю месторождений россыпного типа, где можно добыть палладий, приходится около 2% от объема производства во всем мире. Самые крупные из них размещаются в российских регионах — на Урале и Дальнем Востоке, а также за рубежом:
- в Австралии;
- Колумбии;
- Канаде;
- США.

Преимущественные 98% добываемого палладия достают из глубин земли именно на месторождениях коренного типа. Основными разрабатываемыми рудами считаются:
- медно-никелевые;
- платиновые;
- хромовые.
Статусом стран-лидеров по объему мировой добычи драгоценного металла на таких месторождениях обладают Россия и ЮАР. На почетном первом месте находится предприятие «Норильский никель» — сюда приходится почти половина мирового объема производства. А комплексу Бушвелд (ЮАР) принадлежат наибольшие по объему запасы платиноидов во всем мире.
Переработка руд — основной метод получения палладия, но не единственный. Элемент восстанавливают из вторичного сырья. На этот способ получения приходится приблизительно 10% от общего объема мирового производства.
Ювелирное дело и инвестиции
Ювелиры используют палладий как самостоятельный драгоценный металл, а также как компонент других драгоценных сплавов. Pd является компонентом лигатуры проб платины, а также практически всегда присутствует в качестве элемента золотых сплавов 585 и 750 пробы. Все известное и достаточно популярное на сегодняшний день белое золото обязано своим оттенком добавлению именно этого химического элемента. Сам драгметалл используется в производстве ювелирных украшений тоже не в чистом виде, в высоких пробах в лигатуре сплава присутствует рутений.
Для мировой добычи палладия спрос ювелирной отрасли не имеет решающего значения. Даже не смотря на политику популяризации палладиевых драгоценностей интерес потребителей к ним невелик. Ювелирные заводы предлагают своим клиентам как традиционные украшения для женщин – серьги, кольца, броши, подвески, так и мужские печатки, кресты и запонки. Драгметалл активно используется в последние годы в коллекциях известных модных дизайнеров, представляющих не только украшения, но и стильные и необычные аксессуары: часы, зажигалки, ручки, портмоне.
Где еще применяется драгоценный металл? Палладий по причине своего благородного происхождения относится к числу инвестиционных инструментов. Вложить средства в драгметалл можно разными способами, среди доступных вариантов для обычных клиентов банков числятся покупка слитков и открытие металлического счета. ОМС ведется в граммах «виртуального металла, поэтому при его открытии вы не получите ни грамма Pd на руки. А вот если вы решите приобрести слиток, то сможете ощутить вес металла в своих руках.

Палладий на рынке драгметаллов относят к числу фундаментальных активов, способных принести прибыль только в долгосрочном периоде. Большая часть инвестиций в металл представляет собой фьючерсные контракты на бирже, покупать палладиевые слитки с целью преумножения своих денег нет никакого смысла. Для начинающих инвесторов и обычных банковских клиентов проще всего будет открыть обезличенный счет. Другим своеобразным инвестиционным инструментов, непосредственно связанным с Pd, являются памятные монеты. Монеты из этого металла чеканятся редко и в ограниченном количестве, поэтому рассматривать их как источник получения прибыли нецелесообразно.
Химические
Активное применение палладия в различных сферах деятельности объясняется также и его химическими свойствами. В первую очередь нужно отметить, что он обладает достаточно высокой инертностью, а также гальванической стойкостью, что у современных металлов встречается крайне редко. Такие свойства объясняются атомным строением элемента. Также стоит сказать, что он никак не взаимодействует с кислотами, молекулами воды и щелочами, поэтому простейшие школьные опыты на нем поставить не удастся, хотя и доставать его для таких целей вряд ли кто-то согласится.
Если нагреть металл до 350 градусов, его стойкость будет оставаться стабильной. А вот при увеличении данного показателя он начнет окисляться. В результате такой реакции на поверхности металла образуется тускловатая оксидная пленка. Если же нагреть его до 850 градусов, можно наблюдать ее распад. Объясняется это явление тем, что в диапазоне температур от 800 до 850 градусов элемент уже имеет устойчивость к окислению и не поддается ему.
Не так давно ученые выяснили один интересный факт. Суть его в том, что раствор азотной кислоты способен делать тоньше чистую титановую пластину на 19 мм в год, а в случае сплава палладия с тем же титаном истончение будет происходить гораздо медленнее – всего 0,10 мм в год.
Нагреваясь до 500 градусов, элемент успешно взаимодействует с различными окислителями, в том числе и фтором. Благодаря этому научные работники смогли провести уже немало исследований.
Дополнительным химическим свойством палладия можно назвать его способность усиливать антикоррозионные возможности титана. При добавлении к этому элементу драгоценного металла, его стойкость к агрессивным средам существенно возрастает.

Свойства
Все свойства принято делить на несколько групп
Важно отметить, что некоторые минералы имеют схожие характеристики, поэтому стоит ознакомиться с каждой категорией по отдельности
Физические
Впервые минерал получен в 1803 году химиком из Англии Вильямом Волластоном. За основу было взято название астероида Паллада. Он также был получен в лабораторных условиях за несколько лет до палладия.
У металла металлический цвет с серебристым оттенком. Визуально его можно легко спутать с серебром. Среди основных физических свойств выделяют следующие аспекты:
- Плотность 12 г/см³.
- Градус плавления 1554.
- Твердость 52 кгс/мм².
- Температура кипения 2940.
- Упругость 12600 кгс/мм².
Специалисты относят минерал к категории самых редких металлов. Общее количество на Земле составляет не более 0,000001 %. Первые структурные изменения происходят при температурном режиме 18–20 градусов.
Чтобы изготовить дорогостоящее ювелирное изделие, нередко к палладию добавляют элементы из той же платиновой группы. Например: при дополнительном использовании родия или рутения повышается прочность металла.
Химические
Отличительные характеристики палладия: высокая инертность и гальваническая стойкость, что объясняет особенность атомной структуры. Металл не вступает в химическое воздействие с кислотой, щелочью или водой.
Наблюдается стабильное состояние под воздействием высоких температур в диапазоне 300–350 градусов. Если показатель увеличивается выше установленной отметки, начинается окислительный процесс, что влечет образование на поверхности оксидной пленки.
Под нагревом 800–850 градусов происходит распад веществ. В данном диапазоне появляется стойкость к возникновению окислительного процесса.
Интересный факт: под воздействием раствора из азотной кислоты происходит истончение пластины ежегодно на 19 мм. При использовании сплава палладия и титана возможно снизить данный показатель до 0,1 мм.
При повышении температуры до 500 градусов палладий начинает активно взаимодействовать с другими элементами, например, фтором. Металл помогает усилить антикоррозийный эффект титана, а также стойкость к другим агрессивным химическим элементам.
Биологические
Современное оборудование позволяет продолжать биологические исследования палладия. Поскольку элемент обладает лечебными свойствами, его нередко используют в медицинской отрасли. Например, небольшое количество может потребоваться для производства цитостатических препаратов.
Добыча и промышленное получение
Получение чистого металла выполняется в несколько этапов:
- Подготовка расходного сырья. Его нагревают в специальных фарфоровых котлах. В процессе нагревания котлы заполняются царской водкой.
- Переведение платины в осадок с использованием специальных фильтров. От основы отделяются присадки, сторонние компоненты, которые интересны для получения палладия.
- Обработка фильтрата. Проводится процедура аффинажа, в ходе которой получается труднорастворимое соединение, которое называется дихлордиаммином палладия.
- Очищение нужного металла от примесей.
- Прокаливание. Проводится в герметичных камерах, заполненных водородом.
Полученный губчатый палладий переплавляется в заготовки требуемых размеров и формы.
Добыча руды (Фото: Instagram / khabkrai)
Свойства металла
Палладий — химический элемент, в периодической таблице Менделеева он находится на 46 позиции. Относится к благородным металлам, хотя используется не только в ювелирном деле, но и в промышленности. В природе состоит из шести стабильных изотопов, седьмой, искусственный радиоактивный изотоп, имеет период полураспада более семи миллионов лет. Может образовываться при делении ядер урана и плутония в ядерных реакторах.

Температура плавления палладия равна 1554 градусам Цельсия, плотность — 12г/см3. Он примерно в полтора раза тяжелее железа, но среди металлов своего ряда (платины, иридия и осмия) легче всех почти в два раза. По сравнению с этими металлами, он и обрабатывается гораздо легче — именно поэтому высоко ценится в ювелирном деле.
 Выглядит палладий как металл серебристо-белого цвета. Он плотный, устойчив к коррозии и является парамагнетиком. Даже при добавлении 1% значительно улучшает устойчивость титана к кислотам. Это явление учёные навали самопассивацией (самозащитой) металлов: если в сплавы на основе титана, хрома, свинца или железа ввести даже небольшую дозу благородных металлов, то их коррозиестойкость повышается в десятки и даже сотни раз.
Выглядит палладий как металл серебристо-белого цвета. Он плотный, устойчив к коррозии и является парамагнетиком. Даже при добавлении 1% значительно улучшает устойчивость титана к кислотам. Это явление учёные навали самопассивацией (самозащитой) металлов: если в сплавы на основе титана, хрома, свинца или железа ввести даже небольшую дозу благородных металлов, то их коррозиестойкость повышается в десятки и даже сотни раз.
Его исключительные химические свойства связаны с тем, что на внешней орбите его атома находятся 18 электронов, то есть она полностью заполнена. Благодаря этому металл почти не подвергается внешнему разрушительному воздействию различных веществ. Для того чтобы они вступили во взаимодействие, нужно обеспечить высокую температуру — от 500 градусов по Цельсию.
Ещё одно интересное свойство палладия в том, что он способен поглощать некоторые газы в большом количестве. При комнатной температуре 1 см³ металла может поглотить до 800 см³ водорода. После такого металл изменяется: он вспучивается, трескается и разбухает. Получают металл при переработке серебра, никеля и меди. Около 10% мирового производства получают из переработки вторсырья.

Где используется палладий
- Каталитические нейтрализаторы. Palladium является неотъемлемой частью производства каталитических нейтрализаторов. Металл может улавливать углерод и окислять его до того, как он попадет в воздух в качестве загрязнения.
- Многослойные керамические конденсаторы (MLCC). MLCC помогают контролировать протекание тока в цепях. Сплавы из палладия или палладия и серебра используются при создании MLCC. В гибридных интегральных микросхемах и гальванических материалах также используют палладий.
- Зубная индустрия. Сплавы палладия с золотом, серебром, медью или цинком могут использоваться для изготовления зубных вкладок, коронок и мостов.
- Частные инвесторы и инвестиционные фонды покупают палладий, чтобы защитить свои портфели от потерь из-за инфляции и рыночных кризисов. Инвесторы покупают слитки, монеты и другие продукты, которые содержат этот драгоценный метал.
- Разное. Разнообразные продукты и отрасли полагаются на необычные физические и химические свойства палладия:
- производство этанольного топлива;
- топливные элементы;
- медицина;
- нефтепереработка;
- фотография;
- производство полиэфира;
- водоочистка;
- монеты.
В 1988 году в СССР появились первые монеты из чистого палладия номиналом 25-рублей. Список серии монет с палладием:
- 25 рублей из палладия «Памятник князю Владимиру в Киеве»;
- 25 рублей «Памятник Владимиру Святославичу». СССР. 1988 год. в качестве Proof из палладия 999-й пробы вес 31,1 грамм;
- 25 рублей «Петр I» 1991 г;
- 10 рублей «Русский балет» до 1991 года.
Общий тираж палладиевых монет, которые были выпущенные в СССР за период с 1988 по 1991 года составил около 114 700 экземпляров.
Крупнейшим в мире производителем палладия является завод по производству цветных металлов «Норникель» основанный еще в СССР в 1988-му году (тогда назывался «Норильский никель»). По состоянию на 2017 год было произведено 2,78 млн тройских унций палладия. Это (40% мирового производства).
Сколько стоит палладий? На сегодняшний день цена за 1 грамм палладия достигла до 80$, но она продолжает и будет еще активно расти с каждым годом.
Самые богатые месторождения
Хотя большое количество палладия содержится в кусках упавших на землю метеоритов, основная добыча припадает на рудные месторождения. Именно они обеспечивают около 98% мировых запасов металла.
В мире
Бушвелдский комплекс (ЮАР) — крупнейшее мировое месторождение, где добывают палладий. Здесь старатели находят до 40% мировых запасов драгметалла.

В гораздо меньших объемах его также извлекают в:
- Лак-дез-Иль (Канада);
- Стиллуотер (США);
- Великой Дайке (Зимбабве).
В России
Медно-никелевые месторождения, входящие в состав ОАО «ГМК «Норильский никель», являются крупнейшими в России поставщиками металла:
- Октябрьское;
- Талнахское;
- Норильск-1.
Их суммарная прибыль составляет более 40% от общемировой.

Применение
Катализаторы
Палладий часто применяется как катализатор, в основном в процессе гидрогенизации жиров, крекинге нефти, органическом синтезе (см. катализатор Линдлара, Palladium-catalyzed coupling reactions.
Хлорид палладия PdCl2 используется как катализатор и для обнаружения микроколичеств угарного газа в воздухе или газовых смесях.
Водородные технологии
Так как водород очень хорошо диффундирует через палладий, палладиевые мембраны применяют для глубокой очистки водорода. Для экономии дорогостоящего палладия при производстве мембран для очистки водорода и разделения изотопов водорода разработаны сплавы его с другими металлами (наиболее эффективен и экономичен сплав палладия с иттрием).
Также палладий способен исключительно эффективно обратимо аккумулировать водород. См. Palladium hydride.
Электроника
Хлорид палладия применяется в гальванотехнике, как активирующее вещество при гальванической металлизации диэлектриков — в частности, осаждении меди на поверхность слоистых пластиков при производстве печатных плат.
Применение палладия в контактных узлах обусловлено высокой износоустойчивостью и коррозионной стойкостью палладия. Палладий и сплавы палладия используется для покрытий контактов, устойчивых к действию сульфидов. Палладий используется для производства реохордов прецизионных сопротивлений высокой точности, в том числе в виде сплава с вольфрамом (например, ПдВ-20М).
Палладий входит также в состав керамических конденсаторов (тип КМ), с высокими показателями температурной стабильности ёмкости в высокочастотной аппаратуре радиовещания, радиосвязи, телевидения.
В ювелирном и монетном деле
Памятная монета «Иван III» достоинством в 25 рублей (СССР, 1989 год). Изготовлена из палладия 999 пробы.
- В сплавах, используемых в ювелирном деле (например, для получения сплава золото-палладий — так называемое «белое золото»). Палладий даже в небольшой концентрации в сплаве (около 1 %) изменяет цвет сплава на основе золота из жёлтого в серебристо-белый. Основные сплавы палладия с серебром, используемые в ювелирном деле, имеют пробы 500 и 850 по серебру (так как наиболее технологичны при механической обработке и декоративны).
- Из палладия иногда чеканятся памятные монеты ограниченным тиражом.
В медицине
- Из палладия и его сплавов изготавливают медицинские инструменты, детали кардиостимуляторов, зубные протезы;
- В некоторых странах незначительное количество палладия используется для получения цитостатических препаратов — в виде комплексных соединений, аналогично цис-платине.
- Бета-активный палладий-103 используется для брахитерапии в лечении онкозаболеваний.
Другие области применения палладия
- Для изготовления специальной химической посуды, стойких к коррозии деталей высокоточных измерительных приборов, прецизионных механических инструментов.
- Определённое количество палладия расходуется для изготовления химической аппаратуры для производства плавиковой кислоты (сосуды, перегонные кубы, детали насосов, реторты).
- Палладий является драгоценным металлом и торгуется на биржевых и внебиржевых рынках. В некоторых странах, в том числе в России, законодательство разрешает физическим и юридическим лицам открывать в банках «металлические счета» в палладии. В Российской Федерации за незаконное приобретение, хранение, перевозку, пересылку и сбыт палладия (а равно и других драгоценных металлов золота, серебра, платины, иридия, родия, рутения и осмия) в крупном размере (то есть стоимостью более 2,5 млн рублей.) за исключением ювелирных и бытовых изделий и лома таких изделий, предусмотрена уголовная ответственность в виде лишения свободы на срок до 5 лет.
Примеры решения задач
ПРИМЕР 1
ПРИМЕР 2
| Задание | Сколько атомных орбиталей d — подуровня заполнено у элементов с порядковыми номерами 43 и 76? Запишите их электронные формулы. |
| Решение | На d-подуровне имеется пять орбиталей, на каждой из которых может одновременно находиться 2 электрона (в сумме 10). Элементы с порядковыми номерами 43 и 76 — это технеций (Tc) и осмий (Os). Запишем электронные конфигурации их атомов в основном состоянии: 43 Tc 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4 d 5 5 s 2 ;
76 Os 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 14 5s 2 5p 6 5d 6 6s 2 . В атоме технеция заполнены все 5 орбиталей 4d-подуровня, но не полностью, также, как и в атоме осмия все (5 орбиталей 5d-подуровня). |
| Ответ | 5 и 5. |
/моль (эВ)
Почему палладий стал дороже золота?
Интересный факт! Концентрация палладия в земной коре (1∙10-6 % по массе) в 2 раза выше чем у золота (5∙10-7 %). Но как не парадоксально динамика биржевых цен на палладий обогнала цену на золото:
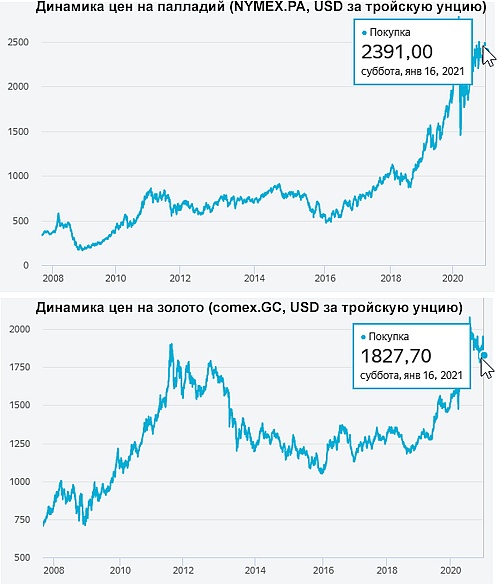
Почему же цена палладия за унцию стала выше цены золотой унции? Ответ очевиден – в последнее время существенно выросло промышленное применение палладия. Хоть золото — это редкий металл и служит еще стабильной валютой и также применяется в промышленности, все же не так активно, как палладий. Динамика роста золота на биржах чаще всего обусловлена эмоциональным фактором, а не фундаментальным. Страх падения экономики стимулирует недоверие к бумажным деньгам и заставляет инвестором приобретать больше золота. Что в свою очередь стимулирует его цену на биржах. Но внутренняя стоимость палладия оказалась выше чем у золота благодаря его более широкому и активному применению в промышленности. Данный факт делает палладий более надежным инвестиционным объектом.
Палладий — это благородный металл относится к Металлам Платиновой Группы на внешний вид сильно похож на серебро, а еще более на самородную платину. Только значительно легче по массе. Свое название получил от названия малой планеты Pallas (в переводе с английского Паллада) между Марсом и Юпитером открытая в 1802-ом году Генрихом Вильгельмом Ольберсом (немецкий астроном). Планета была названа на честь богини мудрости Паллады – любимой дочери Зевса.
Английский химик Уильям Хайд Волластон открыл палладий в 1803 году, когда он смешал платину с азотной кислотой и соляной кислотой, и заметил, что остался еще один элемент. Блестящий ковкий элемент вскоре стал популярным металлом для ювелирного производства.
Однако создание современных стандартов выбросов для автомобилей превратило палладий из металла класса люкс в незаменимый товар для предотвращения загрязнения.
С 1989 года основное использование палладия было сосредоточено на каталитических нейтрализаторах для автомобилей.
Эти трубчатые конструкции улавливают вредные выбросы, которые возникают, когда двигатель сжигает топливо.
Сегодня более 75% из 208 000 килограммов ежегодно добываемого палладия используется автомобильной промышленностью. При чем в дизельных автомобилях в катализаторах используется платина, а в бензиновых палладий.
Уже в 2018 году впервые в Европе бензиновых автомобилей было продано больше чем дизельных. Причина – новые жесткие ограничительные требования к автомобилям по выбросам вредных газов CO2 (у дизеля естественно больше выбросов).
Кроме того, стоит отметить что палладий все более активно используется в медицине и стоматологии. Ведь он абсолютно не вызывает аллергических реакций. Данный металл особенно востребован в производстве кардиостимуляторов. А в последнее время были открыты ценные свойства палладия для использования в противораковых препаратах.
Все эти факты активно стимулируют рост цен палладия на рынке металлов.
Химические свойства
Палладий отличается высокой инертностью и гальванической стойкостью. Эти свойства объясняются особенностью его атомного строения. Металл не взаимодействует с молекулами воды, кислотами и щелочами.
При нагреве до температуры 300–350°C стойкость вещества стабильная. При дальнейшем нагреве металл окисляется кислородом. Результатом химической реакции является появление на поверхности вещества тусклой оксидной пленки.

При нагреве до 800–850°C происходит распад вещества. В этом диапазоне температур металл приобретает устойчивость к окислению.
При температуре 500°C и выше металл взаимодействует с фтором и другими окислителями.
Палладий способствует усилению антикоррозионных свойств титана. Добавление платиноида значительно повышает стойкость титана к агрессивным средам.


































