Что такое цинк
Понятие и особенности
Для начала вашему вниманию предлагается общая характеристика цинка. Этот продукт является не только необходимым производственным металлом, но и важным биологическим элементом. В любом живом организме он присутствует до 4 % от всех элементов.Самые богатые месторождения цинка это Боливия, Иран, Казахстан и Австралия. В нашей стране одним из крупных производителей считается предприятие ОАО «ГМК Дальполиметалл».
Если рассматривать цинк со стороны периодической системе Менделеева, то он относится к переходным металлам и имеет следующие характеристики:
- Номер по порядку: 30
- Масса: 65,37.
- Степень окисления — +2.
- Цвет: синевато-белый.
Если рассматривать цинк со стороны простого вещества, то этот материал имеет следующие характеристики:
- Вид материала – металл.
- Цвет – серебристо-голубой.
- Покрытие – защищен оксидной пленкой, под которой скрывается блеск и сияние.
Цинк содержится в коре земли. Доля металла в ней не очень большая: всего 0,0076%.
Как единичного материала цинка не существует. Он входит в состав многих руд и минералов.
- Наиболее распространенными являются: цинковая обманка, клейофан, марматит. Кроме этого, цинк можно встретить в следующих природных материалах: вюртцит, франкленит, цинкит, смитсонит, каламин, виллемит.
- Спутниками цинка обычно являются: германий, кадмий, таллий, галлий, индий, кадмий.
- Наиболее популярными являются сплавы цинка и алюминия, меди, олова, никеля.
О роли цинка в нашей жизни расскажут специалист в этом видео:
Металлы-конкуренты
С цинком могут конкурировать только 4 металла: титан, алюминий, хром и медь. Описанные материалы имеют следующие характеристики:
- Алюминий: серебристо-белый цвет, хорошо проводит электричество и тепло, поддается обработке давлением, устойчив к коррозии, имеет низкую плотность, применяется в процессе производства стали (для повышения жаростойкости).
- Титан: серебристо-белый цвет, большая температура плавления, при соприкосновении с воздухом окисляется, низкая теплопроводность, легко поддается ковке и штамповке, при высокой температуре на поверхности образуется прочная защитная пленка.
- Хром: синевато-блестящий цвет, высокая твердость, хрупкость, стойкость к окислению в условиях атмосферы и воды, используется для декоративного покрытия.
- Медь: красный металл, имеет высокую пластичность, хорошую электропроводность, высокую теплопроводность, стойкость к коррозионным процессам, применяется в кровельных материалах.
Для строительных целей наиболее часто (кроме цинка) применяют и другие цветные металлы. К ним относятся: бронза, латунь, силумин, баббит, дюралюминий и несколько других.
Плюсы и минусы
Плюсы:
- Хорошая жидкотекучесть, благодаря чему легко заполняются литейные формы.
- Высокая пластичность во время проката.
- Чистый цинк хорошо поддается ковке.
- Благодаря своим свойствам и воздействию температуры способен принимать различные состояния.
- Отлично защищает изделие от коррозии, благодаря чему охотно пользуется спросом в строительстве и машиностроении.
- При нагреве вместе с фосфором или серой может взорваться.
- На воздухе теряет блеск.
- При комнатной температуре имеет маленькую пластичность.
- Не находится в природе в чистом виде.
Масса, механические, химические и физические свойства цинка, его основные характеристики будут рассмотрены нами ниже.
Цинк (Zn)
- Обозначение — Zn (Zincum);
- Период — IV;
- Группа — 12 (IIb);
- Атомная масса — 65,39;
- Атомный номер — 30;
- Радиус атома = 138 пм;
- Ковалентный радиус = 125 пм;
- Распределение электронов — 1s22s22p63s23p63d104s2;
- t плавления = 419,88°C;
- t кипения = 907°C;
- Электроотрицательность (по Полингу/по Алпреду и Рохову) = 1,65/1,66;
- Степень окисления: +2, 0;
- Плотность (н. у.) = 7,13 г/см3;
- Молярный объем = 9,2 см3/моль.
Цинк люди использовали еще до нашей эры в виде его сплава с медью — латуни. Впервые чистый цинк удалось выделить англичанину Уильяму Чемпиону в 18 веке. В земной коре цинка содержится 8,3·10-3% по массе
Много цинка содержится в термальных источниках, из которых происходит осаждение сульфидов цинка, имеющих важное промышленное значение. Цинк играет активную роль в жизни животных и растений, являясь важным биогенным микроэлементом
Цинк в Периодической таблице химических элементов Д. И. Менделеева, стоит под номером «30», относится к переходным металлам (См. Атомы переходных элементов).
Рис. Строение атома цинка.
Электронная конфигурация атома цинка — 1s22s22p63s23p63d104s2 (см. Электронная структура атомов). Предпоследний электронный слой атома цинка полностью заполнен, а на внешнем слое находится два s-электрона, которые и взаимодействуют с другими элементами, поэтому в соединениях цинк проявляется степень окисления +2. (см. Валентность). Цинк обладает высокой химической активностью.
Физические свойства цинка:
- голубовато-белый металл;
- хрупкий при н. у.;
- при нагревании более 100°C хорошо куется и прокатывается;
- обладает хорошей тепло- и электропроводностью.
Химические свойства цинка:
- на воздухе быстро окисляется, покрываясь тонкой пленкой оксида цинка, предохраняющей металл от дальнейшей реакции;
- при нагревании реагирует с кислородом, хлором, серой, образуя оксиды, хлориды, сульфиды соответственно: 2Zn + O2 = 2ZnO; Zn + Cl2 = ZnCl2; Zn + S = ZnS.
- реагирует с разбавленной серной кислотой и растворами кислот неокислителей, вытесняя из них водород: Zn + H2SO4(рзб.) = ZnSO4 + H2; Zn + 2HCl = ZnCl2 + H2;
- реагирует с азотной и концентрированной серной кислотой, восстанавливая азот или серу соответственно: Zn + H2SO4(кнц.) = ZnSO4 + SO2 + 2H2O;
- реагирует при нагревании с растворами щелочей, образуя гидроцинкаты: Zn + 2NaOH + 2H2O = Na2 + H2;
- вытесняет менее активные металлы (см. электрохимический ряд напряжений металлов) из растворов их солей: Zn + CuCl2 = ZnCl2 + Cu.
Получение цинка:
- чистый цинк получают электролизом его солей;
- промышленным способом цинк получают из сульфидных руд: на первом этапе получают оксид цинка, подвергая руду окислительному обжигу: 2ZnS + 3O2 = 2ZnO + 2SO2;
- на втором этапе оксид цинка восстанавливают углем при высокой температуре: ZnO + C = Zn + CO.
Применение цинка:
- в качестве антикоррозионного покрытия металлических изделий (цинкование);
- для изготовления сплавов, широко применяющихся в машиностроении;
- в АКБ и сухих элементах;
- в лакокрасочной промышленности (изготовление цинковых белил);
- как восстановитель в реакциях органического синтеза.
В начало страницы
Производство цинка
Как было сказано выше, чистого вида данного элемента в природе нет. Он добывается из иных пород, таких как руда – кадмий, галлий, минералы – сфалерит.
Металл получают на заводе. Каждый завод имеет свои отличительные особенности производства, поэтому оборудование для получения чистого материала различно. Оно может быть таким:
- Роторы, расположенные вертикально, электролитные.
- Специальные печи с достаточно высокой температурой для обжига, а также специальные электропечи.
- Транспортёры и ванны для электролиза.
В зависимости от принимаемого метода добычи металла, задействовано соответствующее оборудование.
Избыток цинка
Избыток Zn в организме также, как и его нехватка может вызвать ряд проблем со здоровьем, среди которых:
- Расстройства со стороны органов пищеварения – тошнота, рвота, диарея, формирование язвы желудка и двенадцатиперстной кишки;
- Специфический привкус во рту, сухой кашель, сильная жажда;
- Повышенная ломкость и выпадение волос, расслаивание ногтевой пластины;
- Тахикардия;
- Боль в животе, пояснице или при мочеиспускании.
Причины переизбытка Zn
В связи с тем, что цинк не имеет способности накапливаться в организме, отравление ним чаще всего может быть обусловлено употреблением пищи из оцинкованной посуды, или же бесконтрольный прием лекарственных форм этого микроэлемента.
Цинк (Zn)
- Обозначение — Zn (Zincum);
- Период — IV;
- Группа — 12 (IIb);
- Атомная масса — 65,39;
- Атомный номер — 30;
- Радиус атома = 138 пм;
- Ковалентный радиус = 125 пм;
- Распределение электронов — 1s22s22p63s23p63d104s2;
- t плавления = 419,88°C;
- t кипения = 907°C;
- Электроотрицательность (по Полингу/по Алпреду и Рохову) = 1,65/1,66;
- Степень окисления: +2, 0;
- Плотность (н. у.) = 7,13 г/см3;
- Молярный объем = 9,2 см3/моль.
Цинк люди использовали еще до нашей эры в виде его сплава с медью — латуни. Впервые чистый цинк удалось выделить англичанину Уильяму Чемпиону в 18 веке. В земной коре цинка содержится 8,3·10-3% по массе
Много цинка содержится в термальных источниках, из которых происходит осаждение сульфидов цинка, имеющих важное промышленное значение. Цинк играет активную роль в жизни животных и растений, являясь важным биогенным микроэлементом. Цинк в Периодической таблице химических элементов Д
И. Менделеева, стоит под номером «30», относится к переходным металлам (См. Атомы переходных элементов)
Цинк в Периодической таблице химических элементов Д. И. Менделеева, стоит под номером «30», относится к переходным металлам (См. Атомы переходных элементов).
Рис. Строение атома цинка.
Электронная конфигурация атома цинка — 1s22s22p63s23p63d104s2 (см. Электронная структура атомов). Предпоследний электронный слой атома цинка полностью заполнен, а на внешнем слое находится два s-электрона, которые и взаимодействуют с другими элементами, поэтому в соединениях цинк проявляется степень окисления +2. (см. Валентность). Цинк обладает высокой химической активностью.
Физические свойства цинка:
- голубовато-белый металл;
- хрупкий при н. у.;
- при нагревании более 100°C хорошо куется и прокатывается;
- обладает хорошей тепло- и электропроводностью.
Химические свойства цинка:
- на воздухе быстро окисляется, покрываясь тонкой пленкой оксида цинка, предохраняющей металл от дальнейшей реакции;
- при нагревании реагирует с кислородом, хлором, серой, образуя оксиды, хлориды, сульфиды соответственно: 2Zn + O2 = 2ZnO; Zn + Cl2 = ZnCl2; Zn + S = ZnS.
- реагирует с разбавленной серной кислотой и растворами кислот неокислителей, вытесняя из них водород: Zn + H2SO4(рзб.) = ZnSO4 + H2; Zn + 2HCl = ZnCl2 + H2;
- реагирует с азотной и концентрированной серной кислотой, восстанавливая азот или серу соответственно: Zn + H2SO4(кнц.) = ZnSO4 + SO2 + 2H2O;
- реагирует при нагревании с растворами щелочей, образуя гидроцинкаты: Zn + 2NaOH + 2H2O = Na2 + H2;
- вытесняет менее активные металлы (см. электрохимический ряд напряжений металлов) из растворов их солей: Zn + CuCl2 = ZnCl2 + Cu.
Получение цинка:
- чистый цинк получают электролизом его солей;
- промышленным способом цинк получают из сульфидных руд: на первом этапе получают оксид цинка, подвергая руду окислительному обжигу: 2ZnS + 3O2 = 2ZnO + 2SO2;
- на втором этапе оксид цинка восстанавливают углем при высокой температуре: ZnO + C = Zn + CO.
Применение цинка:
- в качестве антикоррозионного покрытия металлических изделий (цинкование);
- для изготовления сплавов, широко применяющихся в машиностроении;
- в АКБ и сухих элементах;
- в лакокрасочной промышленности (изготовление цинковых белил);
- как восстановитель в реакциях органического синтеза.
В начало страницы
Свойства цинковых сплавов
Изделия из цинковых сплавов используют в разных отраслях промышленности и быту. Например, при сборке автомобильной техники цинковые сплавы используют при изготовлении некоторых корпусных деталей, фильтров и множестве других. Электротехническая промышленность применяет цинк для производства щеткодержателей. Сплавы из этого материала обладают высокой пластичностью. И это свойство позволяет его применять для получения отливок сложной формы с тонкими стенками. Цинковые литьевые сплавы не вступают в химическую реакцию с металлом формы и не прилипают к ее поверхности. Параметры этих материалов позволяют изготавливать детали с резьбой.
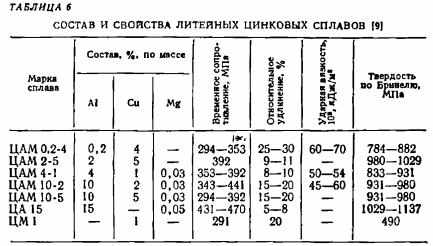
Свойства цинковых сплавов
Между тем механические свойства цинка и сплавов из него характеризует то, что предел прочности лежит в диапазоне 20 – 38 кгс на метр квадратный, а твердость по Бринеллю составляет 65 – 110 единиц. Отливки из цинковых сплавов обладают низкой шероховатостью поверхности, точностью размеров. Заготовки, полученные литьем под давлением хорошо, обрабатываются давлением и резанием. Между тем цинковые сплавы, обладают высокой плотностью – 7 кг на дециметр, а это сопоставимо со сталью. Они имеют не очень высокую стойкость к воздействию коррозии. Наличие в составе сплава таких веществ, как – свинец, кадмий и некоторых других приводит к тому что ускоряются процессы старения. Он сопровождается снижением механических параметров и изменением объема отливки. Ко всему прочему сплавы из этих материалов отличаются повышенной пористостью.
Для улучшения прочностных свойств и приданию цинковым сплавам хорошей коррозионной стойкости, в их состав вводят магний, его концентрация не должна превышать 0,1%. Кроме этого, способа применяют и довольно традиционные методы – никелирование, кадмирование и пр. Свойства сплава определяется наличием тех или иных веществ в составе сплава.
Цинк в медицине
Биологическая роль и функции цинка в организме
Согласно исследованиям ученых, в организме взрослого человека цинк содержится в размере:
- у женщин — 1,5 грамма
- у мужчин — 2,5-3 грамма
Процентное соотношение цинка в организме:
- в коже — 20%
- в костно-мышечной системе — 60%

Основная функция элемента для человеческого организма — это формирование карбоангидраза в эритроцитах для поддержания кислотно-щелочного равновесия. Этот белок обеспечивает преобразование углекислого газа и обратное его перемещение в легкие для последующего выдоха. Цинк, будучи частью 400 пищеварительных ферментов, влияет на полноценное усвоение микроэлементов из пищи.
Помимо основного свойства, цинк выполняет следующие функции:
- Влияет на синтез гормонов. Цинк оказывает влияние на: активность тройных гормонов гипофиза; обмен липидов и холестерина; действие инсулина в крови.
- Есть данные об участии металла в кроветворении, в формировании новых клеток. Это важные функции в период роста и для регенерации тканей.
- Для мужчин особо важен этот микроэлемент, поскольку активно способствует выработке тестостерона. Цинк стимулирует образование семенной жидкости и оказывает положительное влияние на здоровье простаты.
- Является антиоксидантом, нейтрализует действие токсинов и свободных радикалов, предотвращая развитие рака.
- Цинк управляет воспроизводством ДНК и РНК.
- Участвует в синтезе коллагена. Этот фибриллярный белок составляет основу соединительной ткани: суставы, сухожилия, кожа, кости, хрящи. Обеспечивает их прочность и эластичность.
- Цинк «успокаивает» нервную систему, улучшает умственную деятельность, положительно влияет на сон.
- Цинк — ключ к иммунитету. Участвует в метаболизме витаминов А, С, Е, помогает при борьбе с проявлениями аллергии.
Продукты питания, богатые цинком

Цинк из пищи и витаминов всасывается в верхней части кишечника посредством белковых соединений из желудочного сока. Этот микроэлемент обязательно должен быть в рационе мужчин, беременных, кормящих женщин и детей в период их активного роста.
ТОП-10 продуктов питания по содержанию цинка в мкг на 100 грамм:
| 1. | Зародыши пшеницы | 17.000 |
| 2. | Семена кунжута | 7.800 |
| 3. | Овсянка | 6.200 |
| 4. | Яичный желток | 5.600 |
| 5. | Говяжья печень | 5.000 |
| 6. | Арахис | 4.800 |
| 7. | Горох лущеный | 2.440 |
| 8. | Мясо кролика | 2.300 |
| 9. | Цельнозерновой пшеничный хлеб | 2.130 |
| 10. | Гречневая крупа | 2.000 |
Суточная норма потребления цинка
При правильном питании гипоцинкоз (недостаток цинка) человеку не опасен. Лишь при возникновении проблем с всасыванием солей цинка из кишечника и выведением его из организма, могут возникать нарушения обменного характера.
Недостаток цинка часто встречается у детей в период активного роста и у младенцев на грудном вскармливании. В молоке, к сожалению, малое количество необходимого для развития элемента.
У больных сахарным диабетом наблюдается повышенное выделение цинка с мочой и, соответственно, более низкое его содержание в организме.
Для повышения уровня цинка в организме рекомендуется не только добавлять в рацион продукты, богатые этим элементом, но и принимать цинкосодержащие препараты.

Рекомендуемые суточные дозы цинка в зависимости от пола и возраста:
- Новорожденные — 2 мг
- Малыши от 6 мес. до 5 лет — 3 мг
- Дели до 8 лет — 5 мг
- Подростки 8-14 лет — 8 мг
- Мужчины — 15 мг
- Женщины — 10 мг
- Беременные женщины — 15 мг
- Кормящие мамы — до 20 мг
Цинк — незаменимый питательный элемент, обладающий антиоксидантными и противовоспалительными свойствами, участвующий во множестве биологических процессов человеческого организма.
Биологическая роль
Что такое цинк с точки зрения медицины и биологии? Имеет ли он значение для жизни организмов и насколько оно велико? Оказывается, ионы цинка просто обязательно должны присутствовать в живых существах. Иначе дефицит приведет к следующим последствиям:
- анемии;
- снижению инсулина;
- аллергии;
- потере веса и памяти;
- утомляемости;
- депрессии;
- ухудшению зрения;
- раздражительности и другим.
Основные места концентрации ионов цинка в организме человека — это поджелудочная железа, печень и мышцы. Также именно этот металл входит в состав большинства ферментов (например, карбоангидраза). Поэтому большинство реакций катализа происходит при участии цинка.
Что именно делают ионы?
- Участвуют в синтезе мужских гормонов и семенной жидкости.
- Способствуют усвоению витамина Е.
- Участвуют в расщеплении молекул алкоголя в организме.
- Являются непосредственными участниками синтеза многих гормонов (инсулина, гормона роста, тестостерона и других).
- Принимает участие в кроветворении и заживлении поврежденных тканей.
- Регулирует секрецию сальных желез, поддерживает нормальный рост волос и ногтей, способствует регенерационным процессам в коже.
- Обладает способностью устранять из организма токсины и укреплять иммунитет.
- Влияет на формирование вкусовых ощущений, а также обоняния.
- Принимает участие в процессах транскрипции, обмене витамина А, нуклеиновых синтезах и распадах.
- Является участником всех стадий роста и развития клетки, а также сопровождает процесс экспрессии гена.
Все это еще раз доказывает, насколько важным элементом является данный металл. Роль его в биологических системах была выяснена только в XX веке. Многих неприятностей и недугов в прошлом можно было бы избежать, если бы люди знали о лечении при помощи препаратов на основе цинка.
Каким же образом можно поддерживать нужное количество этого элемента в организме? Ответ очевиден. Необходимо употреблять продукты, содержащие цинк. Список может быть длинным, поэтому укажем только те, в которых максимальное количество рассматриваемого элемента:
- орехи и семечки;
- бобовые;
- мясо;
- морепродукты, особенно, устрицы;
- злаки и хлеб;
- молочная продукция;
- зелень, овощи и фрукты.

Природное образование и конечное формирование
Аналогично многим другим металлам, цинк в природе не встречается в чистом виде. Как правило, этот химический элемент присутствует в минералах, сочетаясь с другими элементами, и присутствует как:
- оксид,
- силикат,
- карбонат.
Можно сказать, это традиционная цинковая составляющая. Поэтому, чтобы воспроизвести чистый металл, придётся прибегнуть к переработке сырья цинксодержащего минерала, процедуре, которая предполагает многоступенчатый процесс очистки (включающий несколько отдельных физических и химических этапов).
Природный минерал, содержащий высокий процент химического вещества, широко используемого для самых разных целей. Структура минерала напоминает кварцевые образования характерными вкраплениями-блёстками
Например, для переработки сульфида цинка необходимо измельчить сырьё в порошок, и тщательно промыть, чтобы избавиться от сульфидов других металлов, присутствующих в виде примесей. В конечном итоге получается оксид цинка (ZnO). Выщелачиванием (реакция с серной кислотой) получают раствор сульфата.
Затем используется электролиз (электрохимический процесс) для отделения чистого химического элемента. Также допустимо воспроизводить металл из минерального сырья путём плавки (нагревания углеродом), что традиционно и применяется в промышленном секторе.
История появления и утверждения химическим элементом
Точно неизвестно — кому, где и когда удалось впервые обнаружить цинк. Однако археологами обнаруживались цинковые сплавы в местах, относящихся к доисторическим временам. Достоверно известно – древние римляне производили медные монеты, состав которых включал это вещество, правда, с примесями.
Минуло почти тысяча лет, прежде чем люди начали использовать цинк в качестве металла как такового. Историки предполагают — впервые производство металла отметилось в Индии XIII века. Ещё спустя 300 лет, на территории Китая началось производство цинка в крупных масштабах.
Современная история начала производства цинка исчисляется от середины XVIII века. Первым 1737 году разработал и запатентовал процесс производства чистого цинка английский металлург Уильям Чампион. Производство в огромных промышленных масштабах осуществлялось путём плавки каламина древесным углем.
Между тем вещество окончательно было признано химическим элементом в 1746 году, благодаря усилиям немецкого химика по имени Андреас Сигизмунд Маргграф. Немецкий учёный использовал методы, подобные тем, что использовал Чемпион, с целью детального изучения цинка в стенах лаборатории.
Как был открыт Цинк
Такой химический элемент как цинк свою историю начинает очень давно. Первые известные сведения о применении цинка, пусть даже непреднамеренного, датируются около 14 века до Нашей Эры. Иудейская латунь найденная археологами содержала 23% цинка. Так же найдены украшения на месте раскопок в современной Греции, которые содержат от 80% до 90% цинка созданные ориентировочно в 5 веке до Нашей Эры. Еще одной поразительной находкой археологов являются таблетки, которые были найдены на борту затонувшего римского корабля «Relitto del Pozzino». Эти таблетки представляют собой гидрокарбонат цинка и датируются 140 годом до Нашей Эры. К сведению найденные таблетки являются самыми старыми таблетками в мире, которые предположительно использовались против воспаления глаз.
В период Нашей Эры первые сведения о применении цинка исходят от Римской империи. Они научились изготавливать каламинную латунь путем плавки карбоната цинка, древесного угля и меди. Исходя из исторических сведений из каламинной латуни изготавливалось преимущественно вооружение. Чуть позже(примерно 400 год) в древних текстах индийской медицины(«Чарака самхит») упоминается металл, который при окислении образует «Пушпанджан». Предполагается, что индийский «Пушпанджан» являлся оксидом цинка. Первое плавление цинка началось ориентировочно в XII веке, а в период с XII по XIV век было произведено уже около 60 000 тонн цинка.
Само название металла впервые упоминается в книге Парацельса «Liber Mineralium II» как «цинкен», которая датируется XVI веком. Это слово в переводе с немецкого означает заостренный или зазубренный. Само открытие металла осуществилось гораздо позже, но есть вероятность, что первооткрывателем цинка является немецкий металлург Андреас Либавиус. Он, в 1596 году, взял образец металла с захваченного португальского корабля и описал его физические и химические свойства. По его задокументированному описанию этот металл может быть цинком. Цинк, как отдельный элемент, научились извлекать в Индии еще в конце XIII века, но в Европе он появился только в XVI веке.
Читайте: Медь как химический элемент таблицы Менделеева
Открытие цинка
Возможным претендентом на право открытия цинка принадлежит французскому металлургу и алхимику ПМ де Респуру. В 1668 году он сообщил, что извлек чистый химический элемент из оксида цинка. В начале XVIII века французский исследователь Этьен Франсуа Жоффруа описал как оксид цинка в виде желтых кристаллов конденсируется на слитках железа, помещенных над цинковой рудой. Спустя половину века, в 1738 году Вильям Чампион запатентовал процесс выплавки цинка. Суть патента заключается в выплавке цинка из каламина в вертикальной плавильной печи. Его техника получения цинка напоминала ту, которую использовали в Раджастхане. На сегодняшний день Раджастхан выглядит как северная часть Индии. Научный мир передал право первооткрывателя цинка немецкому химику Андреасу Маргграфу. Хотя шведский химик Антон фон Сваб перегонял цинк из каламина раньше на четыре года. В своем эксперименте 1746 года Маргграф нагревал смесь каламина и древесного угля в закрытом сосуде без меди. В ходе эксперимента он получал чистый цинк.
Читайте: Никель как химический элемент таблицы Менделеева
Цинк витамины. И швец, и жнец
Перечисляя все функции цинка в организме, легко сбиться со счета. Ведь этот микроэлемент трудится практически на всех фронтах. Вот лишь главные его функции:
Укрепление иммунитета, защита от инфекций. Цинк – это естественный иммуномодулятор. При нехватке цинка в крови поднимается уровень кортизола – гормона, подавляющего иммунитет и разрушающего мышечные волокна. Если пить цинк в сочетании с витамином С в холодное время года, можно уберечься от гриппа и ОРВИ.
Участие в образовании костной ткани . Наряду с кальцием этот микроэлемент необходим для формирования и укрепления зубов и костей как у детей, так и у взрослых.
Улучшение работы мозга. Кора головного мозга, недополучая цинк, начинает давать сбой, что может выражаться в появлении галлюцинаций, потере вкуса, нарушении обоняния и даже возникновении эпилептических припадков. Существует связь между содержанием в организме цинка и умственными способностями человека. Исследования показали, что у хорошо успевающих студентов в волосах содержится больше цинка, чем у отстающих. Особенно важен цинк для отделов мозга, отвечающих за концентрацию внимания и память.
Стимуляция половой системы. Мужчинам этот минерал необходим для производства спермы и синтеза тестостерона, а также для профилактики аденомы предстательной железы, а женщинам – для хорошей работы яичников и здорового гормонального фона.
Укрепление зрения. Участвуя в биохимических реакциях сетчатки, цинк помогает усваивать витамин А, важный для нормальной работы глаз. А при его недостатке может развиться катаракта и блефарит.
Цинк — общая характеристика элемента, химические свойства цинка и его соединений
Цинк — элемент побочной подгруппы второй группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 30. Обозначается символом Zn (лат. Zincum). Простое вещество цинк при нормальных условиях — хрупкий переходный металл голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем оксида цинка).
В четвертом периоде цинк является последним d-элементом, его валентные электроны 3d104s2.
В образовании химических связей участвуют только электроны внешнего энергетического уровня, поскольку конфигурация d10 является очень устойчивой. В соединениях для цинка характерна степень окисления +2.
Цинк – химически активный металл, обладает выраженными восстановительными свойствами, по активности уступает щелочно-земельным металлам. Проявляет амфотерные свойства.
Взаимодействие цинка с неметаллами
При сильном нагревании на воздухе сгорает ярким голубоватым пламенем с образованием оксида цинка: 2Zn + O2 → 2ZnO.
При поджигании энергично реагирует с серой: Zn + S → ZnS.
С галогенами реагирует при обычных условиях в присутствии паров воды в качестве катализатора: Zn + Cl2 → ZnCl2.
При действии паров фосфора на цинк образуются фосфиды: Zn + 2P → ZnP2 или 3Zn + 2P → Zn3P2.
С водородом, азотом, бором, кремнием, углеродом цинк не взаимодействует.
Взаимодействие цинка с водой
Реагирует с парами воды при температуре красного каления с образованием оксида цинка и водорода: Zn + H2O → ZnO + H2.
Взаимодействие цинка с кислотами
В электрохимическом ряду напряжений металлов цинк находится до водорода и вытесняет его из неокисляющих кислот: Zn + 2HCl → ZnCl2 + H2; Zn + H2SO4 → ZnSO4 + H2.
Взаимодействует с разбавленной азотной кислотой, образуя нитрат цинка и нитрат аммония: 4Zn + 10HNO3 → 4Zn(NO3)2 + NH4NO3 + 3H2O.
Реагирует с концентрированными серной и азотной кислотами с образованием соли цинка и продуктов восстановления кислот: Zn + 2H2SO4 → ZnSO4 + SO2 + 2H2O; Zn + 4HNO3 → Zn(NO3)2 + 2NO2 + 2H2O
Взаимодействие цинка со щелочами
Реагирует с растворами щелочей с образованием гидроксокомплексов: Zn + 2NaOH + 2H2O → Na2 + H2
при сплавлении образует цинкаты: Zn + 2KOH → K2ZnO2 + H2.
Взаимодействие с аммиаком
С газообразным аммиаком при 550–600°С образует нитрид цинка: 3Zn + 2NH3 → Zn3N2 + 3H2; растворяется в водном растворе аммиака, образуя гидроксид тетраамминцинка: Zn + 4NH3 + 2H2O → (OH)2 + H2.
Взаимодействие цинка с оксидами и солями
Цинк вытесняет металлы, стоящие в ряду напряжения правее него, из растворов солей и оксидов: Zn + CuSO4 → Cu + ZnSO4; Zn + CuO → Cu + ZnO.
Оксид цинка (II) ZnO
– белые кристаллы, при нагревании приобретают желтую окраску. Плотность 5,7 г/см3, температура возгонки 1800°С. При температуре выше 1000°С восстанавливается до металлического цинка углеродом, угарным газом и водородом: ZnO + C → Zn + CO; ZnO + CO → Zn + CO2; ZnO + H2 → Zn + H2O.
С водой не взаимодействует. Проявляет амфотерные свойства, реагирует с растворами кислот и щелочей: ZnO + 2HCl → ZnCl2 + H2O; ZnO + 2NaOH + H2O → Na2.
При сплавлении с оксидами металлов образует цинкаты: ZnO + CoO → CoZnO2.
При взаимодействии с оксидами неметаллов образует соли, где является катионом: 2ZnO + SiO2 → Zn2SiO4, ZnO + B2O3 → Zn(BO2)2.
Гидроксид цинка (II) Zn(OH)2
– бесцветное кристаллическое или аморфное вещество. Плотность 3,05 г/см3, при температуре выше 125°С разлагается: Zn(OH)2 → ZnO + H2O.
Гидроксид цинка проявляет амфотерные свойства, легко растворяется в кислотах и щелочах: Zn(OH)2 + H2SO4 → ZnSO4 + 2H2O; Zn(OH)2 + 2NaOH → Na2;
также легко растворяется в водном растворе аммиака с образованием гидроксида тетраамминцинка: Zn(OH)2 + 4NH3 → (OH)2.
Получается в виде осадка белого цвета при взаимодействии солей цинка со щелочами: ZnCl2 + 2NaOH → Zn(OH)2 + 2NaCl.
Сырье для получения цинка
Основным источником получения цинка являются сульфидные, медно-свинцово-цинковые, медно-цинковые и свинцово-цинковые руды.
В сульфидных рудах цинк обычно присутствует в виде сфалерита или вуртцита, состав которых отвечает формуле ZnS, и марматита nZnS · mFeS. Спутниками цинка в полиметаллических рудах являются минералы и элементы.
В окисленных зонах месторождений цинксодержащих руд основными кислородсодержащими минералами цинка являются: смитсонит ZnCO3, цинкит ZnO и каламин ZnO·SiO2 ·H2O. Окисленные цинковые руды в настоящее время имеют подчиненное значение.
В сульфидных полиметаллических рудах содержание цинка обычно составляет 1…3 %. Эти руды имеют сложный состав. Все это обусловливает необходимость проведения предварительного обогащения руд по селективной схеме с получением нескольких концентратов.
Цинковые концентраты селективного флотационного обогащения полиметаллических руд содержат, %: Zn – 48…60; Pb – 1,5…2,5; Cu – 1…3; Cd – до 0,25; Fe – 3…10; S – 30…38, пустой породы – до 10.
Цинковые концентраты – комплексное дорогостоящее сырьё. Из них нужно извлекать цинк, свинец, медь, кадмий, серу, золото, серебро, ртуть, галлий, индий, таллий, селен, теллур и др.
Иногда при обогащении труднообогатимых медно-цинковых руд получают промежуточные продукты, содержащие 12…18 % Zn и 4…8 % Cu. Переработка этих материалов затруднена как на цинковых, так и на медных заводах.
Переработку цинковых концентратов в настоящее время осуществляют двумя методами – пирометаллургическим и гидрометаллургическим.
В основе пирометаллургического способа лежит процесс восстановления оксида цинка при 1000…1100 ºС, т. е. при температуре выше точки кипения металлического цинка, что обеспечивает выделение его в момент образования в парообразном состоянии и возгонку в виде паров:
ZnO + C = Znпар + CO; ZnO + CO = Znпар + CO2.
Пары цинка в дальнейшем конденсируют. Получение жидкого цинка дистилляцией возможно только в условиях сильно восстановительной атмосферы и полной герметизации применяемой аппаратуры.
В связи с тем что цинковый концентрат представляет собой сульфидный материал, а восстановление цинка возможно только из его оксида, дистилляции предшествует окислительный обжиг с полным удалением серы.
Возможны несколько вариантов аппаратурного оформления пирометаллургического способа получения цинка: в горизонтальных и вертикальных ретортах, в шахтных и электрических печах. Принцип действия положен в основу получения паров цинка в электротермической части кивцетного агрегата.
Получающийся пирометаллургическим способом цинк обязательно содержит большое количество металлов-примесей, возгоняемых вместе с ним или попадающих в него из выносимой газами пыли. Поэтому дистилляционный цинк, как и всякий черновой металл, нуждается в рафинировании.
Пирометаллургический способ применяют с момента возникновения цинкового производства. Доля выпуска цинка этим способом из года в год сокращается и в настоящее время составляет не более 20 %.
Гидрометаллургический способ является в настоящее время основным. Широкое распространение гидрометаллургии при производстве цинка обусловлено ее значительными преимуществами по сравнению с дистилляцией. К ним относятся:
- извлечение большего количества цинка и сопутствующих элементов;
- большая комплексность использования сырья;
- высокое качество цинка;
- высокая механизация трудоемких процессов.
По этому способу цинк выщелачивают раствором серной кислоты из предварительно обожженного концентрата. При выщелачивании цинк переходит в раствор в виде сернокислого цинка по реакции
ZnO + H2SO4 = ZnSO4 + H2O.
При выщелачивании цинкового огарка в раствор частично переходят содержащиеся в нем компоненты. Качество получаемого электролитическим осаждением цинка зависит от чистоты раствора: чем чище раствор, поступающий на электролиз, тем более чистым получается товарный цинк. Поэтому перед электролизом раствор тщательно очищают от примесей.
Процесс электролитического осаждения цинка из очищенного раствора протекает по следующей суммарной реакции:
ZnSO4 + H2O = Zn + H2SO4 + 0,5O2
Цинк при электролизе осаждается на катоде, а на аноде регенерируется серная кислота, необходимая для выщелачивания свежих порций огарка, и выделяется кислород. Катодные осадки цинка переплавляют и разливают в слитки.
Кек (нерастворенный осадок), получаемый после выщелачивания, подвергают дополнительной переработке с целью доизвлечения из него цинка и других ценных компонентов.
История – краткая справка
Первые изделия из латуни, являющейся сплавом меди с цинком датированы еще срединой первого тысячелетия по рождеству Христову. Это были преимущественно предметы интерьера и кухонные предметы, используемые жителями древних Греции, Индии, Китая, Египта и других развитых на то время стран. Получить чистую форму металла удалось дистилляционным способом аж в 1738 году английским ученым Уильямом Чемпионом, который уже в 1743 году запустил работу первого завода по добыче Zn.
Добыча чистейшего цинка с помощью электролитического способа стала возможна уже в 1915 году, на заводах США и Канады.
Свое название Zn – Zincum (Zinken – в переводе с немецкого «зубец») получил от швейцарского исследователя, алхимика и врача Филиппа Парацельса (1493—1541 гг).


































