Химические свойства переходных металлов (меди, цинка, хрома, железа)
Переходные элементы – металлы, расположены в побочных подгруппах периодической системы химических элементов. Так как у них происходит заполнение d-уровней в последнюю очередь, то их относят к d-элементам. Если последним заполняется f-уровень, то это f-элементы. Соответственно, химические свойства обусловлены таким строением атома. Рассмотрим химические свойства некоторых переходных элементов. У всех переходных элементов наблюдается так называемый «проскок электрона», т.е. электрон может переходить на соседнюю орбиталь в пределах одного электронного слоя.
- Взаимодействие с кислородом
- В кислороде железо сгорает, разбрасывая искры – раскаленные капли железной окалины, а при накаливании на воздухе окисляется с поверхности, образуя окалину в виде корки. Во всех случаях образуется железная окалина. 3Fe + 2O2 → Fe3O4
- Медь, цинк и хром вступают в реакцию с кислородом только при нагревании
2Zn + O2 → 2ZnO 4Cr + 3O2 → 2Cr2O3
- Взаимодействие с неметаллами.
- Железо способно реагировать с азотом, фосфором, углеродом и серой. Энергично реагирует при нагревании с серой, образуя сернистое железо.
Fe + S → FeS
- Медь не реагирует с водородом, азотом, углеродом и кремнием. Характерны реакции с серой при нагревании.
- При нагревании цинк взаимодействует с серой и фосфором. С водородом, азотом, бором, кремнием, углеродом цинк в реакции не вступает.
Zn + S → ZnS
- Хром взаимодействует с азотом, серой, бором, углеродом и кремнием при повышенных температурах.
2Cr + 3C → Cr2C3
- Железо способно реагировать с азотом, фосфором, углеродом и серой. Энергично реагирует при нагревании с серой, образуя сернистое железо.
- Взаимодействие с галогенами
- Железный порошок, предварительно нагретый и внесенный в колбу с хлором, сгорает, образуя бурый дым – хлорное железо.
3Cl2 + 2Fe → 3FeCl2
- Медь и хром с галогенами вступает в реакции при нагревании.
Cu + Br2 → CuBr2 2Cr + 3Cl2 → 2CrCl3
- Цинк вступает в реакции с галогенами при нормальных условиях, в качестве катализатора необходимы пары воды.
Zn + Cl2 → ZnCl2
- Железный порошок, предварительно нагретый и внесенный в колбу с хлором, сгорает, образуя бурый дым – хлорное железо.
- При нагревании характерно взаимодействие с водой железа, цинка, хрома. Медь неактивный металл, поэтому с водой не реагирует.
При обычных условиях железо реагирует с парами воды и кислородом. Происходит процесс ржавления и образуется желто-бурая ржавчина – гидрат окиси железа.
3Fe + 6H2O + 3O2 → 4Fe(OH)3↓
- Взаимодействие с кислотами (подробно рассмотрено в разделе «Общие химические свойства металлов»).
- Железо, цинк и хром способны вытеснять из водных растворов солей медь и другие металлы, расположенные правее в ряду активности.
Fe + CuSO4 → Cu + FeSO4
Смотри также:
- Номенклатура неорганических веществ
- Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
- Характерные химические свойства оксидов: оснóвных, амфотерных, кислотных
- Характерные химические свойства оснований и амфотерных гидроксидов
- Характерные химические свойства кислот
- Характерные химические свойства солей: средних, кислых, оснóвных; комплексных ( на примере соединений алюминия и цинка)
- Взаимосвязь различных классов неорганических веществ
Получение
Основное сырье для получения бария — баритовый концентрат (80-95 % BaSO4), который в свою очередь получают флотацией барита. Сульфат бария в дальнейшем восстанавливают коксом или природным газом:
Далее сульфид при нагревании гидролизуют до гидроксида бария Ba(OH)2 или под действием CO2 превращают в нерастворимый карбонат бария BaCO3, который затем переводят в оксид бария BaO (прокаливание при 800 °C для Ba(OH)2 и свыше 1000 °C для BaCO3):
Металлический барий получают из оксида восстановлением алюминием в вакууме при 1200—1250 °C:
4BaO + 2Al = 3Ba + BaAl2O4.
Очищают барий перегонкой в вакууме или зонной плавкой.
Способы получения
Для получения гидроксидов на чистые химические элементы воздействуют водой без примесей. Реакция должна протекать при комнатной температуре. При этом выделяется водород.
Для получения чистых щелочноземельных металлов проводится разложение сложных веществ на более простые. После этого осуществляться восстановление. Для получения стронция, кальция, магния применяется технология электролиза. Барий, бериллий получают с помощью восстановления. Сложнее всего добывать чистый радий. Для его получения нужно перерабатывать урановую руду.
Банки с жидкостью для электролиза (Фото: Instagram / take_n_make)
История
Двойное название группы – отражение природы и характеристик входящих в нее элементов:
- Они способны образовывать щелочи.
- Ряд свойств их оксидов близки окислам алюминия и железа. Такие вещества еще средневековые алхимики именовали «землями».
Сегодняшний состав щелочноземельной группы сформировался не сразу: бериллий и магний отсутствовали.
Это объяснялось отличием свойств данных элементов от остальных:
- По большинству характеристик они ближе к алюминию, чем к другим элементам группы.
- Их гидроксиды – не щелочи.
- Магний взаимодействует с водой в замедленном режиме, у бериллия реакция в таком растворе нулевая. Та же картина при контакте с неметаллами.
Однако специалисты Международного союза теоретической и прикладной химии (IUPAC) решили все-таки причислить бериллий и магний к щелочноземельной группе.
Щёлочноземельные металлы — основные свойства, характеристика и список элементов

Щёлочноземельные металлы получили свое название за счет своих оксидов, которые сообщают воде щелочные реакции. Изучая химию, очень часто приходится взаимодействовать со сложными и непонятными названиями. Но если разобраться и понять что к чему, то изучать предмет легко и интересно.
Однако при написании формул стоит быть внимательным, не забывая про коэффициенты и признаки реакций.
Положение в периодической системе Менделеева

Щелочноземельные металлы – это химические элементы второй группы периодической системы химических элементов таблицы Менделеева:
- бериллий Be;
- магний Mg;
- кальций Ca;
- стронций Sr;
- барий Ba;
- радий Ra.
Электронное строение и закономерности изменения свойств
Атомы данных металлов на внешнем энергетическом уровне имеют 2 s-электрона. Отсюда следует, что максимальная степень окисления +2.
- Также могут иметь нулевую степень окисления, но не отрицательную, так как металлы не могут иметь данную степень.
- Общая конфигурация внешнего энергетического уровня nS2:

В периоде от Be до Ra металлические свойства, восстановительные, электроотрицательные увеличиваются, а неметаллические, окислительные свойства и радиус атома уменьшается.
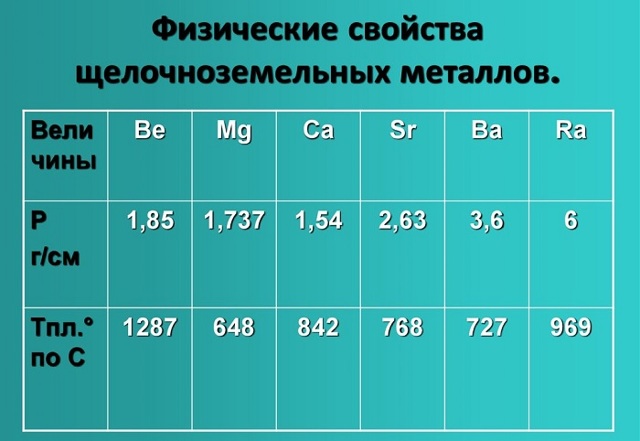
Физические свойства щелочноземельных металлов
- Физические свойства данной группы имеют следующие характеристики: светло-серый — темно-серый цвет, твердые вещества, не растворимые и нелетучие, без запаха, тепло-электропроводимые, имеют характерный металлический блеск.
- Показатели плотности и температуры плавления представлены в таблице:
Химические свойства
Оксиды и гидроксиды щёлочноземельных металлов усиливают основные свойства при движении вниз по второй группе. Следовательно, бериллий имеет меньшие основные свойства, чем радий.
- Эти вещества взаимодействуют с любыми растворами кислот от сильной до слабой, а также с образованием солей, образуя белый осадок.
- 4Ca + 5H2SO4 (конц) = 4CaSO4 + H2S + 4H2O.
- С кислородом образуют реакцию горения и оксид:
- 2Mg + O2 = 2MgO.
- Металлы, стоящие в главной подгруппе второй группы (кроме бериллия) реагируют с водой. При проведении данных реакций выделяется водород (H2):
- Mg + 2H2O = Mg(OH)2 + H2,
- Вa + 2H2O = Вa(OH)2 + H2.
- Также реагируют с неметаллами:
- Bа + Cl2 = BаCl2 — хлорид бериллия;
- Ca + Br2 = CaBr2 — бромид кальция;
- Sr + H2 = SrH2 — гидрид стронция.
- Химические свойства щелочноземельных металлов показаны на картинке:

Нахождение в природе
Все металлы данного типа встречаются на земле, но не в чистом виде. Часто они представлены в виде минеральных солей. Самый распространённый считается кальций, магний немного уступает, затем идет барий и стронций.
Бериллий и радий являются самыми редкими, однако последний металл в больших количествах находится в урановых рудах.

Способ получения
- Магний, кальций и стронций получают электролизом расплавов солей.
- Барий получают с помощью восстановления оксида.
- При нагревании фторида бария получают сам металл.
Качественные реакции
- Одна из качественных реакций-окрашивание пламени.
- Список возможных цветов пламени при нагревании данных элементов:
- Ca — темно-оранжевый;
- Sr — насыщенный красный;
- Ba — светло-зеленый или классический зеленый.

Металлы данного типа при взаимодействии с щелочами, оксидами или растворами солей выпадают в белый осадок.
Применение щелочноземельных металлов
Бериллий из-за своей прочности добавляют в различные сплавы металлов, также препятствует коррозии. Используется в изготовлении рентгеновских аппаратов.
Магний и кальций активно использует для лекарственных средств, поскольку данные металлы играют большую роль в жизнедеятельности организма. Также в медицине используют радий, но для облучения кожи и злокачественных образований.
Стронций и барий добавляют в различный сплавы, которые работают в агрессивной среде и имеют сверхсильную проводимость.
Данные металлы играют огромную роль в жизни человека, выполняют различные функции и имеют ряд определенных свойств. Они содержатся в земной коре, поэтому довольно широко используются. Однако это не говорит о том, что их нужно расходовать безгранично.
Щелочные металлы
Щелочные металлы — это элементы главной подгруппы I группы Периодической системы химических элементов Менделеева (ПСМ) (кроме водорода).
Задание 9.1. Назовите все щелочные металлы. Составьте схемы строения атомов натрия и калия. Укажите распределение их валентных электронов.
На внешнем уровне у атомов таких металлов находится по 1 электрону, но расстояние до ядра, а значит, и притяжение к нему, у этих электронов различно.
Вопрос. У какого элемента (натрия или калия) внешние электроны дальше от ядра?
Чем дальше электроны от ядра, тем слабее они притягиваются к нему, тем легче данный атом отдаёт электроны. А это означает, что металлические свойства выражены тем ярче, чем дальше валентные электроны от ядра (при прочих равных условиях). Поэтому сверху вниз в каждой главной подгруппе увеличивается число энергетических уровней в атомах, растёт металлическая активность элементов, т. е. способность их атомов отдавать электроны.
Вопрос. Какой металл более активный: натрий или калий?
Таким образом, активность щелочных металлов возрастает
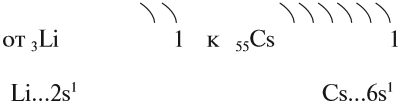
Но поскольку на внешнем уровне любого щелочного металла находится один электрон, в любой химической реакции щелочные металлы могут отдать только один электрон. Значит, они имеют постоянную валентность I и образуют оксиды состава
Этот оксид растворяется в воде, реагирует с нею:
Полученное основание — щёлочь.
Вопрос. Что такое щёлочь? (См. урок 2.3.)
В подгруппе сверху вниз увеличивается и сила оснований, т. е. способность диссоциировать в водных растворах на ионы. Самой сильной щёлочью является CsOH.
Растворы щелочей мылкие на ощупь, разъедают кожу и ткани (щёлочи — едкие!), изменяют окраску индикаторов. Поскольку все металлы главной подгруппы I группы образуют щёлочи, — их называют «щелочные металлы».
Рассмотрим свойства щелочных металлов на примере натрия. При этом будем придерживаться схемы, изложенной начале второй части.
Строение атома Nа изображается схемой:
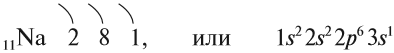
Имея один валентный электрон (…3s1), натрий является активным металлом с постоянной валентностью I:
Простое вещество «натрий» — очень лёгкий (легче воды) серебристо-белый металл, который легко режется ножом. Натрий активно реагирует с кислородом, водородом, неметаллами, водой:

Вопрос. Почему атом серы присоединил 2 электрона?
Задание 9.2. Составьте уравнения реакций натрия с хлором Cl2, азотом N2 и водой (при затруднениях см. пояснения в уроке 7).
Даже небольшие кусочки натрия (величиной с горошину) при попадании в воду вызывают оглушительный взрыв — это взрывается водород (см. урок 12). Тот же эффект будет, если натрий опустить в раствор кислоты или соли. Кроме того, здесь возможны более сложные побочные процессы. Поэтому составлять уравнения реакций для щелочных металлов в качестве примеров процессов
- металл + раствор кислоты →
- металл + раствор соли →
не рекомендуется.
Натрий образует основный оксид Nа2O, который реагирует с водой, с кислотами и кислотными оксидами (см. урок 2.1), например:
Задание 9.3. Составьте уравнения реакций оксида натрия с водой и с серной кислотой.
Гидроксид натрия NaOH (едкий натр, каустическая сода) проявляет все свойства щелочей: реагирует с кислотными оксидами, кислотами, растворами солей (см. урок 2.3), например:

Все соединения натрия окрашивают пламя в жёлтый цвет. Это качественная реакция на соединения натрия.
Задание 9.4. Составьте уравнения реакций гидроксида натрия с хлоридом железа III, фосфорной кислотой, оксидом серы IV. (При затруднениях см. урок 2.3.)
Задание 9.5. Опишите по разобранной схеме свойства калия и его соединений.
Многие соединения натрия нашли применение в быту и промышленности. Так, каустическая сода NаОН применяется для получения мыла, в производстве алюминия, искусственных волокон и др. Кальцинированная сода Na2CO3 также применяется при получении мыла, а также при варке стекла, стирке белья и др. Но в пищу эти «соды» не употребляются! При приготовлении пищи используют питьевую соду NaHCO3 и поваренную соль NaCl. Питьевая сода используется при лечении простуды, её кладут в печенье, пирожки. Без соли NaCl почти любая еда покажется невкусной, без неё невозможно законсервировать мясо, овощи, грибы. Эти вещества применяются и в технических целях.

Химические свойства Mg, Ca
- при нагревании выше 600°C магний сгорает на воздухе ослепительно ярким белым пламенем (при н. у. магний защищен оксидной пленкой), с образованием оксида и нитрида магния: O2 + 2Mg = 2MgO; N2 + 3Mg = Mg3N2;
- кальций на влажном воздухе быстро реагирует с кислородом покрываясь рыхлой пленкой (смесь оксида и гидроксида кальция), при нагревании в кислороде воспламеняется: O2 + 2Ca = 2CaO;
- при н. у. легко реагируют с галогенами, образуя галогениды: Ca + Cl2 = CaCl2; Mg + Cl2 = MgCl2;
- при нагревании реагируют с неметаллами, образуя гидриды, нитриды, сульфиды, карбиды:
- H2 + Mg = MgH2;
- N2 + 3Ca = Ca3N2;
- S + Mg = MgS;
- 2C + Ca = CaC2.
- при кипячении магний вытесняет из воды водород, образуя гидроксид магния (кальций реагирует с водой при н. у.): 2H2O + Mg = Mg(OH)2 + H2; 2H2O + Ca = Ca(OH)2 + H2;
- реагируют с соляной и разбавленной серной кислотой: Ca + 2HCl = CaCl2 + H; Mg + H2SO4(рзб) = MgSO4 + H2;
- реагируют с разбавленной азотной кислотой, образуя нитрат аммония: 4Mg + 10HNO3(рзб) = 4Mg(NO3)2 + NH4NO3 + 3H2O;
- с концентрированной азотной кислотой (магний реагирует при нагревании): 4Mg + 10HNO3(кнц) = 4Mg(NO3)2 + N2O + 5H2O;
- с концентрированной серной кислотой: 4Mg + 5H2SO4(кнц) = 4CaSO4 + H2S + 4H2O;
- поскольку атомы элементов 2(IIa) группы являются сильными восстановителями, магний и кальций используются в реакциях восстановления металлов из их оксидов и галогенов, что находит широкое практическое применение в реакциях метллотермии, когда для получения редкоземельных металлов используют гораздо более распространенные щелочноземельные металлы:
- магнийтермия (в вакууме): 2RbCl + Ca = 2Rb + CaCl2;
- кальцийтермия (в вакууме): 2CsCl + Mg = 2Cs + MgCl2.
Получение магния и кальция
- электролизом расплавов солей: MgCl2 → Mg + Cl2;
- металлотермией (промышленный способ) при t>1200°C в электропечи в условиях вакуума, восстанавливая металлы из их соединений: 3CaO + 2Al = 3Ca + Al2O3;
- углетермией (восстановлением оксидов углем) в электропечи при t>2000°C: MgO + C = Mg + CO.
Применение
- Be:
- в качестве легирующей добавки к сплавам, придавая им твердость и прочность;
- как замедлитель и отражатель нейтронов в атомной промышленности.
- Mg:
- широко используется в конструкционных сверхлегких сплавах в автомобиле- и авиастроении;
- для получения редкоземельных металлов методом металлотермии;
- в органическом синтезе;
- в фото- и пиротехнике.
- Ca:
- в металлургии для удаления различных примесей при выплавке сталей и других сплавов;
- для получения редкоземельных металлов методом металлотермии;
- для выделения из воздуха инертных газов.
Стронций
Впервые стронций обнаружили в минерале стронцианите (карбонате стронция), найденном в 1764 г. в свинцовом руднике близ шотландской деревни Стронциан. Через четверть века ирландский химик Адер Кроуфорд (1748—1795), изучив этот минерал, высказал мнение, что в нем содержится не известный науке элемент. Это подтвердил в 1808 г. Г. Дэви, выделив его электролизом. Стронций — серебристо-белый металл. Он мягче кальция, плавится при более низкой температуре. По химическим свойствам он очень похож на кальций и всюду сопровождает его: в минералах, костях, зубной эмали. Стронций нетоксичен; содержание его в организме среднего человека около 0,3 г. Природный стронций представлен четырьмя стабильными изотопами, известно также более 30 радиоактивных изотопов стронция с периодами полураспада от миллиардных долей секунды до почти 29 лет для 90Sr. Поэтому, если вместе со стабильным стронцием в организм попадет этот радионуклид, он внедряется в костную ткань, и «изгнать» его оттуда практически невозможно. Реклама чудодейственных средств, «выводящих из организма все радионуклиды», — обман.
Длительное облучение может привести к раку костного мозга и лучевой болезни. По активности 1 г 90Sr соответствует 137 г радия! Даже через 100 лет остается 10% от активности 90Sr. А чтобы она снизилась почти до нуля, должно пройти несколько тысяч лет. Этот опаснейший радионуклид в больших количествах попал в атмосферу при испытаниях ядерного оружия. Поэтому больше всего стронция-90 в костях людей, родившихся в период 1945—1980 гг., когда было проведено больше всего ядерных взрывов в атмосфере.
Минерал целестин (сульфат стронция). Мировое производство соединений стронция в 2012 г. составило 380 тыс. т.
В больших количествах оксид стронция раньше использовали для получения стекла, из которого делали электроннолучевые трубки. Раньше такие трубки имели все телевизоры, мониторы и осциллографы в лабораториях: стронций не пропускал наружу рентгеновские лучи (они возникают в месте удара электронного луча о стекло). В пиротехнических составах соли стронция окрашивают пламя в карминово-красный цвет.
Образуется 90Sr и во время работы ядерного реактора, поэтому присутствует в отработанном топливе. Во время чернобыльской аварии в атмосферу попало примерно 1,6 кг 90Sr.
Бериллий
Элементы второй группы имеют историческое название «щелочноземельные». Землями химики когда-то называли тугоплавкие, практически не растворимые в воде вещества, которые выделяли из минералов и горных пород. Какое-то время считалось, что это простые вещества, потом выяснили, что «земли» — это оксиды элементов. Но вы-делить из них металлы в чистом виде иногда удавалось лишь спустя многие десятилетия: так прочно они были связаны с кислородом. Первая же часть слова «щелочноземельные» связана с тем, что эти «земли» имели свойства щелочей — они реагировали с кислотами, давали мылкие на ощупь растворы, а при нагревании с жирами разлагали их. В чистом виде и по химическим свойствам элементы второй группы напоминают соседей по пер-вой группе, но отличаются намного меньшей активностью. Они тоже реагируют с водой с выделением водорода, но намного медленнее.
Луи Никола Воклен — французский химик.
Бериллий был открыт (в виде оксида) в 1798 г. французским химиком Луи Никола Вокленом (1763—1829) при анализе минерала берилла — сложного алюмосиликата. Такой же состав имеют изумруд и аквамарин (цвет у драгоценных камней возникает из-за примесей других элементов). Название минерала берилла (по-гречески berillos) восходит к названию города Белур (Вел-луру) в Южной Индии, недалеко от Мадраса; с древних времен в Индии были известны месторождения изумрудов.
Более простой состав у золотистого минерала хризоберилла — алюмината бериллия (по-гречески chrysos — золото). Соли бериллия оказались сладкими (тогда не знали об их ядовитости), поэтому новый элемент называли также глицинием, от греч. glykys — сладкий.
Бериллий обладает редчайшим сочетанием легкости и высокой температуры плавления. Он на 50% более упругий, чем сталь, и при этом в четыре раза легче. Такое сочетание незаменимо для космической промышленности. Из бериллия и его сплавов делают платформы спутников, зеркала космических телескопов: бериллий можно отполировать до блеска.
Бериллиевая руда — гельвин.
Мировое производство бериллия в 2012 г. составило 230 тонн. В основном он идет на производство бериллиевой бронзы — сплава с медью, содержащем до 3% бериллия. Она упругая и износостойкая, из нее получаются прекрасные пружины. Сталь с добавками бериллия не дает при ударе искры, из нее делают инструменты для работы в пожаро- и взрывоопасной атмосфере. В отличие от других металлов, пластинки из бериллия свободно пропускают рентгеновское излучение. При этом они хорошо отражают также инфракрасные лучи.
Изумруд — зеленая разновидность хризоберилла.
Бериллий — один из элементов, без которых невозможны высокие технологии. Вот один пример. Для анализа продуктов столкновения протонов в Большом адронном коллайдере их нужно вывести из основной камеры через коническую трубу. Лучшим материалом для нее оказался бериллий. Из него российские металлурги сделали то, что не могли сделать в других странах: в Женеву были отправлены конические и одновременно идеально прямые трубы длиной от 2 до 4 метров с тонкими стенками — от 1,4 до 2,4 мм. Такую трубу легко поднимает один Бериллий токсичен, обладает аллергическим и канцерогенным действием. Вдыхание пыли, содержащей частицы металла и его соединений, приводит к заболеванию легких — бериллиозу. Содержание бериллия в организме среднего человека — сотые доли миллиграмма.
Магний и его характеристика
Химия щелочноземельных металлов изучает свойства магния, акцентируя внимание на некоторых его особенностях. Он представляет собой очень легкий, серебристо-белый металл
Магний, расплавленный в атмосфере с высокой влажностью, активно поглощает из водяного пара молекулы водорода. Остывая, металл практически полностью выделяет их обратно в воздух. Он очень медленно реагирует с водой по причине образования малорастворимого соединения – гидроксида магния. Щелочи на магний не действуют вовсе. Не реагирует металл с некоторыми кислотами: концентрированной сульфатной и плавиковой, вследствие его пассивации и образования на поверхности защитной пленки. Большинство же минеральных кислот растворяют металл, что сопровождается бурным выделением водорода. Магний – сильный восстановитель, он замещает многие металлы из их оксидов или солей:
BeO + Mg = MgO + Be.
Металл вместе с бериллием, марганцем, алюминием применяют в качестве легирующей добавки к стали. Особенно ценными свойствами обладают магнийсодержащие сплавы — электроны. Их используют в самолетостроении и производстве автомобилей, а также в деталях оптической техники.

Практическое применение
Применение щелочноземельным металлам нашла не только природа. Научились это делать и люди.

Бериллий нашел применение в производстве ракетного топлива, а также сплавов, в том числе для атомных станций. Кальций, хорошо зарекомендовавший себя в качестве основы скелетов живых существ, нашел свое применение и при производстве строительных материалов. Кроме того, этот элемент используется при получении топлива, а также в фармацевтической промышленности.
Магний, основные свойства которого —это легкость и пластичность, хорошо поддаётся прокату и ковке. Из сплавов, содержащих этот металл, изготавливают детали и предметы, для которых важен низкий вес:
- металлические листы и профили;
- корпуса электронной техники.
Такие сплавы востребованы во многих отраслях промышленности (военной, электронной, космической, авиационной, автомобильной, приборостроительной).
Основные сферы применения солей стронция:
- радиоэлектрическая;
- металлургическая;
- пиротехническая;
- энергетическая;
- производство урана;
- производство магнитных материалов;
- изготовление керамики;
- медицинская промышленность, где изотоп этого вещества используется в качестве противоопухолевого средства.
Барий нашёл место это в атомной энергетике, оптики, в производстве вакуумных приборов. Благодаря свойству не растворяется в воде, сульфат этого металла используется в медицине в качестве контрастного вещества при рентгенографии и рентгеноскопии.
Люди нашли применение и редкому элементу радию. Используется он как при исследованиях в ядерной сфере, так и в медицине для лечения опухолей. От изготовления светящейся краски на основе радия пришлось отказаться в связи с опасностью этого вещества для людей.


































