[править] Биологическая роль
Алюминий входит в состав тканей животных и растений; в органах млекопитающих обнаружено от 10 −3 до 10 −5 % алюминия (на сырое вещество). Алюминий накапливается в печени, поджелудочной и щитовидной железах. В растительных продуктах содержание алюминия колеблется от 4 мг на 1 кг сухого вещества (картофель) до 46 мг (желтая репа), в продуктах животного происхождения — от 4 мг (мёд) до 72 мг на 1 кг сухого вещества (говядина). В дневном рационе человека содержание алюминия достигает 35-40 мг. Известны организмы — концентраторы алюминия, например плауны (Lycopodiaceae), которые содержат в золе до 5,3 % алюминия, моллюски (Helix и Lithorina), в золе которых 0,2-0,8 % Алюминия.
Образуя нерастворимые соединения с фосфатами, алюминий нарушает питание растений (поглощение фосфатов корнями) и животных (всасывание фосфатов в кишечнике).
Взаимодействие алюминия со сложными веществами
с водой
Как уже было сказано выше, стойкая и прочная оксидная пленка из Al2O3 не дает алюминию окисляться на воздухе. Эта же защитная оксидная пленка делает алюминий инертным и по отношению к воде. При снятии защитной оксидной пленки с поверхности такими методами, как обработка водными растворами щелочи, хлорида аммония или солей ртути (амальгирование), алюминий начинает энергично реагировать с водой с образованием гидроксида алюминия и газообразного водорода:
с оксидами металлов
После поджигания смеси алюминия с оксидами менее активных металлов (правее алюминия в ряду активности) начинается крайне бурная сильно-экзотермическая реакция. Так, в случае взаимодействия алюминия с оксидом железа (III) развивается температура 2500-3000оС. В результате этой реакции образуется высокочистое расплавленное железо:
2AI + Fe2O3 = 2Fe + Аl2О3
Данный метод получения металлов из их оксидов путем восстановления алюминием называется алюмотермией или алюминотермией.
с кислотами-неокислителями
Взаимодействие алюминия с кислотами-неокислителями, т.е. практически всеми кислотами, кроме концентрированной серной и азотной кислот, приводит к образованию соли алюминия соответствующей кислоты и газообразного водорода:
2Аl + 6Н+ = 2Аl3+ + 3H2;
-концентрированной серной кислотой
Взаимодействие алюминия с концентрированной серной кислотой в обычных условиях, а также низких температурах не происходит вследствие эффекта, называемого пассивацией. При нагревании реакция возможна и приводит к образованию сульфата алюминия, воды и сероводорода, который образуется в результате восстановления серы, входящей в состав серной кислоты:
Такое глубокое восстановление серы со степени окисления +6 (в H2SO4) до степени окисления -2 (в H2S) происходит благодаря очень высокой восстановительной способности алюминия.
— концентрированной азотной кислотой
Концентрированная азотная кислота в обычных условиях также пассивирует алюминий, что делает возможным ее хранение в алюминиевых емкостях. Так же, как и в случае с концентрированной серной, взаимодействие алюминия с концентрированной азотной кислотой становится возможным при сильном нагревании, при этом преимущественно параллельно протекают реакции:
— разбавленной азотной кислотой
Взаимодействие алюминия с разбавленной по сравнению с концентрированной азотной кислотой приводит к продуктам более глубокого восстановления азота. Вместо NO в зависимости от степени разбавления могут образовываться N2O и NH4NO3:
8Al + 30HNO3(оч. разб) = 8Al(NO3)3 + 3NH4NO3 + 9H2O
со щелочами
Алюминий реагирует как с водными растворами щелочей:
так и с чистыми щелочами при сплавлении:
В обоих случаях реакция начинается с растворения защитной пленки оксида алюминия:
Аl2О3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
Аl2О3 + 2NaOH = 2NaAlO2 + Н2О
В случае водного раствора алюминий, очищенный от защитной оксидной пленки, начинает реагировать с водой по уравнению:
Образующийся гидроксид алюминия, будучи амфотерным, реагирует с водным раствором гидроксида натрия с образованием растворимого тетрагидроксоалюмината натрия:
Al(OH)3 + NaOH = Na[Al(OH)4]
Область применения
Сплавы с алюминием используются при строительстве. Благодаря ему строения становятся надежными, долговечными, уменьшается металлоемкость. Основной областью применения сплавов является именно стройка, поскольку добавление материала позволяет эксплуатировать конструкции в экстремальных условиях и не беспокоиться за результат.

Кровельные материалы с алюминием дешево стоят, не требуют профилактического ремонта, дольше используются. Такая кровля еще и не уступает остальным материалам по декоративным особенностям.
Для внешней отделки конструкции используются стеновые панели с добавлением алюминия. Они состоят из листов, облицовки и утеплителя. Материал легкий, поэтому не дает сильную нагрузку на фундамент, хорошо удерживает тепло, но всегда дешево стоит.
Соединения с алюминием используются в фармацевтике для лечения тяжелых форм болезней. Они усиливают выработку антител и не имеют побочных эффектов.

При контакте с пищей алюминий не разрушает витамины, поэтому его часто используют в пищевой промышленности. Материал используют для производства посуды, бытовой химии и косметических средств. В разных отраслях промышленности с добавлением этого металла создают аппаратуру, которая помогает перерабатывать пищу. Фольга, столовые приборы, посуда, кухонная техника — все это делают с добавлением алюминия, поскольку он не влияет на вкус продуктов, но при этом защищает их от внешних факторов.
ПРИМЕНЕНИЕ

Украшение из алюминия
Широко применяется как конструкционный материал. Основные достоинства алюминия в этом качестве — лёгкость, податливость штамповке, коррозионная стойкость. Электропроводность алюминия всего в 1,7 раза меньше, чем у меди, при этом алюминий приблизительно в 4 раза дешевле за килограмм, но, за счёт в 3,3 раза меньшей плотности, для получения равного сопротивления его нужно приблизительно в 2 раза меньше по весу. Поэтому он широко применяется в электротехнике для изготовления проводов, их экранирования и даже в микроэлектронике при напылении проводников на поверхности кристаллов микросхем. Когда алюминий был очень дорог, из него делали разнообразные ювелирные изделия. Так, Наполеон III заказал алюминиевые пуговицы, а Менделееву в 1889 г. были подарены весы с чашами из золота и алюминия. Мода на ювелирные изделия из алюминия сразу прошла, когда появились новые технологии его получения, во много раз снизившие себестоимость. Сейчас алюминий иногда используют в производстве бижутерии.
Алюминий (англ. Aluminium) — Al
| Молекулярный вес | 26.98 г/моль |
| Происхождение названия | от латинского alumen |
| IMA статус | утверждён в 1978 |
Способы получения
Бокситная руда – это глинозем (45-58%) плюс соединения железа, титана, кремнезем. Ее транспортируют на обогатительную фабрику.
Для очистки глинозема применяют процесс К.И.Байера:
- Руду загружают в автоклав, где нагревают с едким натром, охлаждают.
- Отделяют твердый осадок.
- Гидроокись осаждают, прокаливают.
На выходе получают оксид алюминия, то есть чистый глинозем. Его тестируют на калибровку и чистоту, затем превращают в алюминий.
Свойства алюминия делают невозможным применение классических для металлов способов восстановления.

Сегодня металл высвобождают способом, придуманным в конце XIX века (метод Холла-Эру).
Изучается возможность производства металлического алюминия через частичное восстановление. Образуется карбид алюминия, который разлагают при 1950°С. По расчетам, он рентабельнее классического.
Из нефелинов попутно получают кальцинированную соду, поташ, цемент, удобрения.
Алюминий, свойства атома, химические и физические свойства.
Al 13 Алюминий
26,9815386(8) 1s2 2s2 2p6 3s2 3p1
Алюминий — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 13. Расположен в 13-й группе (по старой классификации — главной подгруппе третьей группы), третьем периоде периодической системы.
Атом и молекула алюминия. Формула алюминия. Строение алюминия
Цена на алюминий
Изотопы и модификации алюминия
Свойства алюминия (таблица): температура, плотность, давление и пр.
Физические свойства алюминия
Химические свойства алюминия. Взаимодействие алюминия. Реакции с алюминием
Получение алюминия
Применение алюминия
Таблица химических элементов Д.И. Менделеева
Химические свойства
Алюминий — серебристо-белый легкий металл, технический состав плавится при температуре 658 градусов, чистый — при 660, а закипает он при 2518, 8. К физическим свойствам относится и пластичность. Она у вещества очень высокая: 35% и 50% у промышленного и природного сплава соответственно. Его можно раскатать до состояния фольги или тонкого листа.

Модуль Юнга у алюминия составляет 70 ГПа, коэффициент Пуассона — 0,34. Он отлично отражает свет, проводит тепло и электричество. Вещество может взаимодействовать практически со всеми металлами, образует сплавы с кремнием, магнием, медью.
В нормальных условиях алюминий покрыт прочной тонкой оксидной пленкой, поэтому на него не действуют обычные окислители. Но он реагирует на разбавленные серные растворы.
Но если пленка разрушилась — ее могут повредить соли аммония, горячие щелочи или амальгамирование, то вещество превращается в восстановитель. Галий, олово и индий не дают ей образоваться, при этом поверхность металла нужно покрыть легкоплавкими эвтектиками.
Перечень того, с чем реагирует алюминий:
- кислородом;
- галогенами;
- неметаллами;
- водой и ее парами;
- щелочами;
- соляной, азотной и серной кислотами.

При реакции с кислородом образуется оксид алюминия, его формула — 4Al + 3O2 = 2Al2O3. Фторид вещества: 2Al + 3F2 = 2AlF3. Сульфид образуется при взаимодействии с серой:2Al + 3S = Al2S3, 2Al + N2 = 2AlN — это нитрид металла, 4Al + 3C = Al4C3 — карбид после реакции с углеродом.
Характерная степень окисления алюминия — плюс три, но его атомы могут образовывать дополнительные связи. При взаимодействии со щелочами образуется тетрагидроксоалюминат (или другие алюминаты): 2Al + 2NaOH + 6H2O = 2Na (Al (OH)4) + 3H2. Металл можно растворить в разбавленной серной кислоте: 2Al + 3H2SO4 = Al2 (SO 4)3 + 3H2.
Интересна реакция алюминия с водой. Для нее необходимо удалить защитную пленку с помощью раствора горячей щелочи или амальгамы: 2Al + 6H2O = 2Al (OH3) + 3H2. При взаимодействии с окислителями происходит разложение вещества: 2Al + 6H2SO4 = Al2 (SO4)3 + 3SO2 + 6H2O — растворимые соли, уравнение реакций. Химические свойства алюминия включают восстановление металлов из оксидов, реакцию с парами воды.
Технологические свойства
Легкость, с которой алюминий может быть переработан в любую форму – технологичность, является одним из наиболее важных его достоинств. Очень часто он может успешно конкурировать с более дешевыми материалами, которые намного труднее обрабатывать:
- Этот металл может быть отлит любым методом, который известен металлургам-литейщикам.
- Он может прокатан до любой толщины вплоть до фольги, которая тоньше листа бумаги.
- Алюминиевые листы можно штамповать, вытягивать, высаживать и формовать всем известными методами обработки металлов давлением.
- Алюминий можно ковать всеми методами ковки
- Алюминиевая проволока, которую волочат из круглого прутка, может затем сплетаться в электрические кабели любого размера и типа.
- Почти не существует ограничений формы профилей, в которые получают из этого металла методом экструзии (прессования).
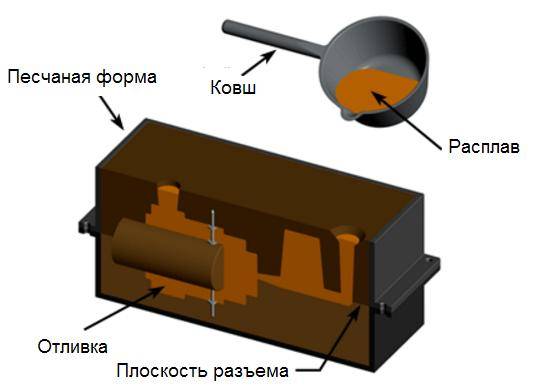
Рисунок 18.1 – Литье алюминия в песчаную форму
Рисунок 18.2 – Непрерывная разливка-прокатка алюминиевой полосы

Рисунок 18.3 – Операция высадки при изготовлении алюминиевых банок
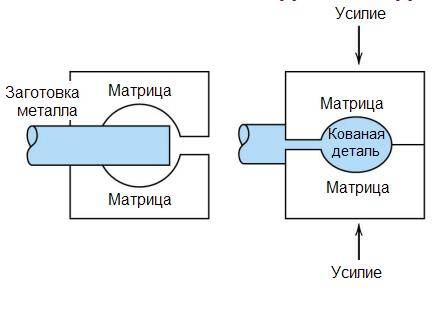
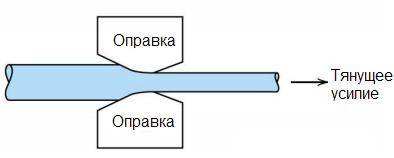
Рисунок 18.5 – Холодное волочение алюминия

Источник
Гидроксид алюминия
Al2 (OH)3 является типичным амфотерным гидроксидом. В соединении с кислотой это вещество образует соль, содержащую положительно заряженные ионы алюминия, в щелочах образует алюминаты. Амфотерность вещества проявляется в том, что он может вести себя и как кислота, и как щелочь. Это соединение может существовать и в желеобразном, и в твердом виде.
В воде практически не растворяется, но вступает в реакцию с большинством активных кислот и щелочей. Физические свойства гидроксида алюминия используются в медицине, это популярное и безопасное средство снижения кислотности в организме, его применяют при гастритах, дуоденитах, язвах. В промышленности Al2 (OH)3 используется в качестве адсорбента, он прекрасно очищает воду и осаждает растворенные в ней вредные элементы.
Защита алюминия от коррозии
Алюминий и его сплавы отличаются отличной устойчивостью к разрушениям различного характера. Однако, несмотря на это — коррозия алюминия представляет собой не такое уж и редкое явление. Различные формы коррозии представляют собой основную причину порчи этих материалов. Для борьбы с разрушительными процессами необходимо обязательно понимать факторы, которые являются причиной их появления.
Коррозия алюминия представляет собой реакцию, которая имеет место между металлом и окружающей средой. Этот процесс может иметь как естественное, так и химическое происхождение. Самой распространенной формой разрушения металла можно назвать появление на его поверхности процессов ржавления.
Особенностью всех видов металлов можно назвать их свойство вступать в реакцию с водой и окружающей средой. Отличием для каждого вида металла считается только интенсивность данного процесса. К примеру, у благородных металлов типа золота скорость такой реакции не будет слишком быстрой, а вот железо, в том числе и алюминий, будут реагировать на воздействия такого характера достаточно быстро.
Можно выделить два фактора, которые оказывают непосредственное влияние на интенсивность протекания процесса коррозии. Одним из них можно назвать степень агрессивности окружающей среды, а вторым металлургическую или химическую структуру. Атмосфере, которая нас окружает, всегда характерен определенный уровень влажности. Кроме того, ей характерен определенный уровень загрязнений и отходов.
Если учесть, что свойства атмосферы часто определяются регионом и степенью индустриализации, на сегодняшний день можно выделить:
- сельская местность (малая степень загрязнений и средний уровень влажности);
- приморские области (средняя степень загрязнений и высокий уровень влажности);
- городская местность (средний уровень влажности и средний уровень продуктов распадов жидкого топлива, серы и окислов углерода);
- промышленные и индустриальные зоны (большое количество серы, окислов углеродов и кислот, а также средний уровень влажности)
Самыми мощными растворителями можно назвать фтор, калий и натрий. Кроме того, алюминию характерна довольно низкая сопротивляемость к соединениям хлора и брома. Весьма агрессивны к различным сплавам алюминиевых металлов, являются известковые и цементные растворы.
Можно выделить несколько разновидностей проявления коррозии алюминия и его сплавов:
- Поверхностная. Данный тип разрушения встречается чаще всего и является наименее вредоносным. Его легче всего заметить на поверхности. Это дает возможность своевременно использовать предохранительные средства. Поверхностные разрушения очень часто встречаются на анодированных профилях для строительства.
- Локальная. Такие разрушения проявляются в виде форм, углублений и пятен. Такой тип коррозии бывает поверхностного и междукристаллического типа. Разрушения такого характера являются особенно опасными, по причине того, что их достаточно сложно обнаружить. Такая коррозия очень часто разрушает именно труднодоступные части конструкций и узлов.
- Нитеподобная или филигранная. Этот вид разрушения алюминия часто появляется под покрытиями органического типа, а также на граничных поверхностях обработки. Нитеподобная коррозия появляется в ослабленных местах повреждения органического покрытия или краях отверстий;
Удельное электрическое сопротивление
Принятая величина удельного электрического сопротивления сверхчистого алюминия (99,990 %) при 20 ºС составляет 2,2548×10 -8 Ом·м или 64,94 % от Международного стандарта отожженной меди (IACS). Электрическое сопротивление алюминия чистоты 99,9 % при различных температурах показано в таблице 5.
Таблица 5 – Удельное электрическое сопротивление чистого алюминия (99,90 %)

Электрическая проводимость чистого алюминия является изотропной, если только в нем не присутствуют ориентированные дислокации.
Влияние размера зерна на удельное электрическое сопротивление в промышленном алюминии является незначительным. Однако, нагартованный алюминий имеет в направлении полученной холодной пластической деформации несколько более высокую – на 0,5-1,0 % – электрическую проводимость.
Физические свойства алюминия зависят от его чистоты
|
Таблица физических свойств алюминия |
|
| Температура плавления Тпл, °С | 660 |
| Температура кипения Ткип, °С | 2 327 |
| Скрытая теплота плавления, Дж/г | 393,6 |
| Теплопроводность l , Вт/м град (при 20° С) | 228 |
| Теплоемкость Ср, Дж/(г · град) (при 0–100°С) | 0,88 |
| Коэффициент линейного расширения α × 10-6, 1/°С (пр°С) | 24,3 |
| Удельное электросопротивление ρ × 10-8, Ом× м (при 20°С) | 2,7 |
| Предел прочности σ в, МПа | 40–60 |
| Относительное удлинение δ , % | 40–50 |
| Твердость по Бринеллю НВ | 25 |
| Модуль нормальной упругости E , ГПа | 70 |
Плотность алюминия
Плотность твердого и расплавленного алюминия снижается по мере увеличения его чистоты: Плотность алюминия при 20°С
| Степень чистоты, % | 99,25 | 99,40 | 99,75 | 99.97 | 99,996 | 99.9998 |
| Плотность при 20°С, г/см3 | 2,727 | 2,706 | 2,703 | 2,6996 | 2,6989 | 2,69808 |
Плотность расплавленного алюминия при 1000°С
| Степень чистоты, % | 99,25 | 99.40 | 99.75 |
| Плотность, г/см3 | 2,311 | 2,291 | 2,289 |
Температура плавления и кипения.
В момент плавления алюминия возрастает объем металла: для алюминия чистотой 99,65 % — на 6,25%, для более чистого металла — на 6,60 %. По мере повышения степени чистоты алюминия температура его плавления возрастает: Зависимисть температуры плавления алюминия от чистоты
| Степень чистоты, % | 99,2 | 99,5 | 99,6 | 99,97 | 99,996 |
| Температура плавления, °С | 657 | 658 | 659,7 | 659,8 | 660,24 |
Теплопроводность алюминия
Теплопроводность алюминия повышается с увеличением степени его чистоты. Для технического алюминия (99,49 и 99,70%) теплопроводность при 200°С равна соответственно 209 и 222 Вт/(м×К). Для электролитически рафинированного алюминия чистотой 99,9% теплопроводность при 190°С возрастает до 343 Вт/(м×К). Примеси меди, магния и марганца в алюминии снижают его теплопроводность. Например, добавка 2 % Mn к алюминию снижает теплопроводность с 209 до 126 Вт/(м×К).
Электропроводность алюминия
Алюминий отличается высокой электропроводностью (четвертое место среди металлов — после серебра, меди и золота). Удельная электропроводность алюминия чистотой 99,99 % при 20°С равна 37,9 мкСм×м, что составляет 63,7% от электропроводности меди . Более чистый алюминий обладает электропроводностью, равной 65,9% от электропроводности меди. На электропроводность алюминия влияет ряд факторов: степень деформации, режим термической обработки и т. д., решающую же роль играет природа примесей, присутствующих в алюминии. Примеси по их отрицательному влиянию на электропроводность алюминия можно расположить в следующий ряд: Cr, V, Mn, Ti, Mg, Ag, Сu, Zn, Si, Fe Ni. Наиболее отрицательное влияние на электросопротивление алюминия оказывают примеси Сг, V, Мп и Ti . Поэтому в алюминии для электротехнической промышленности сумма Cr+V+Mn+Ti не должна превышать 0,015% (марка А5Е) и даже 0,01 % (А7Е) при содержании кремния соответственно 0,12 и 0,16 %.
Влияние примесей на электропроводность алюминия
Основными примесями в алюминии являются кремний, железо, медь, цинк и титан. При малых содержаниях кремния в алюминии (0,06%) величина Fe : Si (в пределах от 0,8 до 3,8) сравнительно мало влияет на его электросопротивление. При увеличении содержания кремния до 0,15—0,16% влияние Fe : Si возрастает. Ниже приведено влияние Fe : Si на электропроводность алюминия: Влияние Fe : Si на электропроводность алюминия
| Fe : Si | 1,07 | 1,44 | 2,00 | 2,68 | 3,56 |
| Удельное электросопротивление алюминия, ×10-2 мкОм·мм: | |||||
| нагартованного | 2,812 | 2,816 | 2,822 | 2,829 | 2,838 |
| отожженного | 2,769 | 2,771 | 2,778 | 2,783 | 2,788 |
Удельное электрическое сопротивление отожженной алюминиевой проволоки (ρ, мкОм·м) при 20°С в зависимости от содержания примесей можно приблизительно определить по следующей формуле: ρ=0,0264+0,007×(% Si)+0,0007×(% Fe) + 0,04×.
Отражательная способность
С повышением степени чистоты алюминия возрастает его способность отражать свет от поверхности. Так, степень отражения белого света от прокатанных алюминиевых листов (фольги) в зависимости от чистоты металла, возрастает следующим образом: для Аl 99,2%—75%, Аl 99,5%—84% и для Аl 99,8%—86%. Поверхность листа, изготовленного из электролитически рафинированного алюминия чистотой 99,996%, отражает 90% падающего на него белого света.
www.metmk.com.ua
Химические свойства
Алюминий — серебристо-белый легкий металл, технический состав плавится при температуре 658 градусов, чистый — при 660, а закипает он при 2518, 8. К физическим свойствам относится и пластичность. Она у вещества очень высокая: 35% и 50% у промышленного и природного сплава соответственно. Его можно раскатать до состояния фольги или тонкого листа.

Модуль Юнга у алюминия составляет 70 ГПа, коэффициент Пуассона — 0,34. Он отлично отражает свет, проводит тепло и электричество. Вещество может взаимодействовать практически со всеми металлами, образует сплавы с кремнием, магнием, медью.
В нормальных условиях алюминий покрыт прочной тонкой оксидной пленкой, поэтому на него не действуют обычные окислители. Но он реагирует на разбавленные серные растворы.
Но если пленка разрушилась — ее могут повредить соли аммония, горячие щелочи или амальгамирование, то вещество превращается в восстановитель. Галий, олово и индий не дают ей образоваться, при этом поверхность металла нужно покрыть легкоплавкими эвтектиками.
Перечень того, с чем реагирует алюминий:
- кислородом;
- галогенами;
- неметаллами;
- водой и ее парами;
- щелочами;
- соляной, азотной и серной кислотами.

При реакции с кислородом образуется оксид алюминия, его формула — 4Al + 3O2 = 2Al2O3. Фторид вещества: 2Al + 3F2 = 2AlF3. Сульфид образуется при взаимодействии с серой:2Al + 3S = Al2S3, 2Al + N2 = 2AlN — это нитрид металла, 4Al + 3C = Al4C3 — карбид после реакции с углеродом.
Характерная степень окисления алюминия — плюс три, но его атомы могут образовывать дополнительные связи. При взаимодействии со щелочами образуется тетрагидроксоалюминат (или другие алюминаты): 2Al + 2NaOH + 6H2O = 2Na (Al (OH)4) + 3H2. Металл можно растворить в разбавленной серной кислоте: 2Al + 3H2SO4 = Al2 (SO 4)3 + 3H2.
Интересна реакция алюминия с водой. Для нее необходимо удалить защитную пленку с помощью раствора горячей щелочи или амальгамы: 2Al + 6H2O = 2Al (OH3) + 3H2. При взаимодействии с окислителями происходит разложение вещества: 2Al + 6H2SO4 = Al2 (SO4)3 + 3SO2 + 6H2O — растворимые соли, уравнение реакций. Химические свойства алюминия включают восстановление металлов из оксидов, реакцию с парами воды.
Предостережение
Алюминий не заложен изначально в биологические организмы. Но человек получает его микродозы ежедневно – с пищей.
Им богаты горох, пшеница, рис, овсяный «геркулес». Доказана польза алюминия как стимулятора регенерации, развития тканей, работы ЖКТ, ферментов.
По стандартам РФ, в литре питьевой воды не должно быть более 0,2 мг алюминия.
Алюминиевой посудой пользоваться можно, но ограниченно. Безопасны готовка, подогрев, хранение продуктов с нейтральными характеристиками. Приготовление кислых блюд (щи, томат, компот) опасно. Алюминий поступит в еду, создавая избыточную дозу при попадании в организм, плюс «железный» привкус.
Травление алюминия кислотой
Ввиду того, что в данном процессе применяются очень сильные кислоты, то прежде всего необходимо соблюдать повышенные меры предосторожности при работе с ними. Оператор должен надевать перчатки, маску, фартук
Важно, чтобы помещение, где происходит сам процесс, хорошо проветривалось. Не имея определенных навыков и без определенных средств защиты работать с кислотами не рекомендуется
Как уже отмечалось выше, изделие из алюминия помещается в емкость с кислотой. Наиболее часто при химическом травлении алюминия кислотой применяют следующие реагенты: соляная или серная кислоты. При взаимодействии их с металлом выделяется водород. Внешне это выглядит следующим образом: поверхность изделия покрывается мелкими пузырями. Но, в принципе, это можно предотвратить, если заранее добавить в емкость специальный ингредиент. Таким образом металл будет защищен от пузырьков тончайшей пленкой.

Очень важный момент: все операции по травлению изделия из алюминия кислотой необходимо выполнять интенсивно, чтобы сама поверхность металла осталась целостной.
Описываемый способ рекомендуется проводить в емкостях из дерева или бетона. При этом внутренняя поверхность ее должна быть облицована кислотоупорной плиткой, чтобы не разъедались стенки емкости.
Такой метод применяется на практике не очень часто.
Как был открыт алюминий
Алюминий – это легкий металл, относящийся к парамагнетикам. В чистом виде его можно встретить лишь в жерлах вулканов, но в ничтожно малом количестве. А между тем элемент значительно широко распространен в земной коре, но только в виде различных соединений.
И среди металлов он занимает лидирующее положение, поскольку его концентрация приближается к 8 % от общей массы элементов. Больше его на Земле только кислорода и кремния. А если сравнить залежи с золотом, то количество последнего всего пять миллионных долей от одного процента (0,000005 %).
Алюминий можно встретить буквально везде. Есть он в тканях животных и растений. Также подтверждено присутствие и в воде. В ней он в основном находится в виде соединения – фторида алюминия. И если в морской воде его концентрация достигает лишь 0,01 мг/л, то в некоторых пресных водоемах количество доходит даже до 10 мг/л.
Но для серьезной разработки этого недостаточно. Поэтому основная добыча алюминия приходится на получение его из бокситов, алунитов и нефелинов. А также из базальтов, гранита и даже глины. И в основном в них он содержится в виде алюмосиликата. А в России самые богатые залежи находятся в районе Урала и Сибири.

Рудник боксит Тимана в РоссииИсточник news.myseldon.com
Первые упоминания о применении алюминия пришли к нам из древности. Люди натолкнулись на вещество, которое имело отличные связывающие свойства. Его назвали квасцами и стали использовать при дублении кожи.
Именно латинское название квасцов (alumen) и послужило для обозначения современного алюминия. А в те времена так именовали горькую соль. Ведь состояло вещество из алюмокалия. И впервые разобрать квасцы на составляющие попытался Парацельс в 16 столетии. Он отделил от вещества «квасцовую землю». Так был получен оксид алюминия.
Но названия у элемента в то время не было. А появилось оно только в 18 веке, когда эксперименты Парацельса стал повторять немецкий химик Маргграф. Свойства металла заинтересовали научный мир своей уникальностью. И с этого момента не прекращались попытки получить алюминий в чистом виде.

Готовый к отправке на производство алюминийИсточник berezovskiy.pulscen.ru
Кроме немецких ученых в борьбу вступили также английские и датские физики. И среди последних отличился Ганс Эрстед. Лабораторным путем он смог из хлорида алюминия выделить чистый металл. Восстановление проводилось амальгамой калия при нагревании.
Впоследствии немецкий химик Вёлер улучшил способ. А в 1854 году французский ученый Сент-Клер Девиль, заменив калий на более безопасный натрий, смог добиться более стабильных результатов. И уже через два года предоставил ученому сообществу первый алюминиевый слиток, полученный полупромышленным способом.
В те временя электролиз требовал значительных финансовых затрат. Поэтому не удивительно, что алюминий был дороже золота. Последнее все же присутствовало в аналитических весах, которые были подарены Дмитрию Менделееву от имени британского ученого мира. За его выдающиеся заслуги.
Чашки измерительного прибора были сделаны из алюминия, что по тем временам считалось чуть ли непозволительной роскошью. Выполнить прибор полностью из такого дорогого металла не смогли позволить себе даже столь богатые колонизаторы. Поэтому алюминий частично заменили на золото.

Весы из алюминия, подаренные Менделееву британскими ученымиИсточник dom.sibmama.ru
С начала двадцатого столетия цены на электроэнергию стабилизировались. Поэтому алюминий начали добывать в промышленных масштабах. Именно этот период ознаменовался открытием большинства инновационных технологий, где начали применять алюминий.
[править] Химические свойства
Алюминий — химически активный элемент. В электрохимическом ряду напряжений он стоит рядом с щелочными и щелочноземельными элементами. Его стандартный электродный потенциал равен −1,67 В.
При обычных условиях алюминий легко взаимодействует с кислородом воздуха и покрывается тонкой (2 · 10 −5 см), но прочной оксидной пленкой Al2О3 (пассивация), которая защищает его от дальнейшего окисления, обуславливая этим высокую коррозионную стойкость, придает ему матового вида и сероватого цвета. Однако при содержании в алюминия или окружающей среде ртути, натрия, магния, кальция, кремния, меди и других элементов прочность оксидной пленки и ее защитные свойства резко снижаются.
При 25 °C алюминий реагирует с хлором, бромом, йодом образуя соответственно хлорид алюминия, бромид алюминия, йодид алюминия, при 600 °C — с фтором, образуя фторид алюминия.
Порошкообразный алюминий при температуре выше 800 °C образует с азотом нитрид алюминия. При взаимодействии атомарного водорода с парами алюминия при −196 °C образуется гидрид (AlH) x (x = 1, 2). Выше 200 °C алюминий реагирует с серой, образуя сульфид алюминия. С фосфором при 500 ° C образует фосфид AlP. При 1200 °C алюминий реагирует с углеродом, образуя карбид алюминия. В присутствии расплавленных солей (криолит и др.) эта реакция протекает при меньшей температуре — 1000 °C
Выше 800 °C могут образоваться соединения одновалентного алюминия, например
\mathrm{Al_2X_3 + 4\ Al \rightarrow 3\ Al_2X \;\;(X \in \{O, S, Se\})}
С рядом металлов и неметаллов алюминий образует сплавы, в которых содержатся интерметаллические соединения — алюминиды, обычно достаточно тугоплавкие и обладают высокой твердостью и жаростойкостью.
Благодаря образованию оксидной пленки алюминий довольно устойчив не только в отношении воздуха, но и воды . С водой алюминий не взаимодействует даже при нагревании. Но когда оксидную пленку разрушить, алюминий энергично взаимодействует с водой, вытесняя водород :
\mathrm{2\ Al + 6\ H_2O \rightarrow 2\ Al(OH)_3 + 3\ H_2\uparrow \;}
Алюминий обладает амфотерными свойствами, он реагирует с кислотами и щелочами .
Он легко взаимодействует с разбавленными азотной и серной кислотами:
- \mathrm{2\ Al + 6\ HNO_3 \rightarrow Al(NO_3)_3 + 3\ NO_2\uparrow + 3H_2O}
- \mathrm{2\ Al + 3\ H_2SO_4 \rightarrow Al_2(SO_4)_3 + 3\ H_2\uparrow}
Очень разбавленные, а также очень крепкие HNO 3 и H 2 SO 4 на алюминий почти не действуют. В отношении ортофосфорной и уксусной кислот алюминий устойчив. Чистый металл также устойчив к соляной кислотакислоте, но обычный технический в ней растворяется.
В растворах сильных щелочей (NaOH, KOH) алюминий растворяется с выделением водорода и образованием алюминатов:
\mathrm{2\ Al + 2\ NaOH + 6\ H_2O \rightarrow 2\ Na + 3\ H_2\uparrow}
Достаточно энергично он разъедается также раствором NH4OH.
Производство алюминия
До начала позапрошлого века не было достоверной информации о производстве металла. Первые несколько миллиграммов получил Ганс Эрстед в 1825. Через два года Фридрих Велер выделил крупинки, но они моментально покрывались пленкой на воздухе.

До конца XIX столетия вещество не производили в промышленных масштабах. И только в 1854 при финансировании Наполеона III, который надеялся об усилении армии с помощью металла, Сент-Клер Девиль вытеснил алюминий натрием из двойного хлорида натрия. Через год он получил первый слиток массой 6 кг, а до 1890 ученый смог создать более 200 т вещества.
В 1885 году построили первый завод в Гмелингеме, Германия. Технологию для производства разработал Николай Бекетов. Его метод мало отличался от способа Сент-Клер Девиля, но основывался на взаимодействии магния и криолита. За пять лет работы завод создал более 58 т металла, что составило четверть мирового производства.
Эру и Холл практически одновременно изобрели еще один метод — электролиз глинозема. Его растворяли в расплавленном криолите. Он и стал основой современного создания алюминия. В России первый завод появился в 1932 году, тогда промышленность СССР порадовала 47,7 млн т металла. Стимулировала производство Вторая мировая война.
А к 2016 в мире сделали около 59 млн т, лидерами стали:
- Китай;
- РФ;
- Канада;
- США;
- Австралия.
[править] Получение
Получение алюминия
Алюминий получают электролизом раствора глинозема (техн. Al2O3) в расплавленном криолите Na3[AlF6] при 950—960 °C. Состав электролита 75−90 % по массе Na3[AlF6], 5−12 % AlF3, 2−10 % CaF2, 1−10 % Al2O3, молярное отношение NaF / AlF3 = 2,20−2 85.
Промышленный комплекс по получению алюминия включает производство глинозема из алюминиевых руд, криолита и других фторидов, углеродистых анодных и футеровочных материалов и собственно электролитическое получение алюминия.
Электролиз проводят в аппаратах катодом в которых служит дно ванны, анодом — предварительно обожженные угольные блоки или электроды, помещенные в расплавленный электролит.
Расплавленный алюминий при температуре электролиза тяжелее, чем электролит, поэтому накапливается на дне ванны. На аноде выделяется O2, который взаимодействует с углеродом анода, который выгорает, образуя СО и СО2.
Плотность тока на аноде 0,7−0,9 А / см, на катоде — 0,4−0,5 А / см, для различных типов электролизеров сила тока составляет 100−250 кА, рабочая напряжение 4,2−4,5 В.
Для получения 1 т чернового алюминия расходуется 14500−17500 кВт · ч электроэнергии, 1925−1930 кг глинозема, 500−600 кг анодного материала, 50−70 кг фтористых солей. Суточная производительность одной ванны средней мощности — от 550 до 1200 кг алюминия. Алюминий отбирают из электролизера один раз в 1−2 суток.
Алюминий высокой чистоты (не более 0,05 % примесей) получают электролитическим рафинированием чернового алюминия, содержащий до 1 % примесей. В качестве электролита чаще всего используют расплав Na3[AlF6], BaCl2 (до 60 %) NaCl (до 4 %). Для получения алюминия особой чистоты (не более 0,001 % примесей) применяют зонную плавку.
Алюминий разливают в слитки, которые затем перерабатывают в листы, фольгу, профили, проволока. Он хорошо сваривается, поддается ковке, штамповке, прокатке, волочению и прессованию, а также обрабатывается методами порошковой металлургии.






























