Труды Менделеева
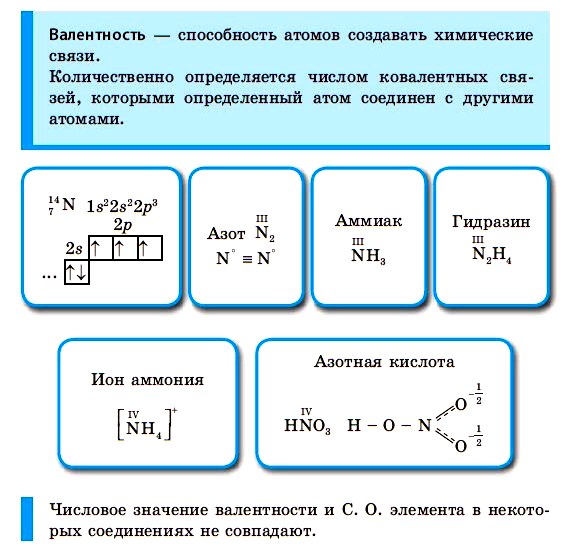
Согласно электронной теории, В. атома определяется из числа непарных электронов (Э)., участвующих в формировании пар с Э. других атомов. Понятие В. связано с созданием закона Менделеева.
Теория электронов
Атомы представляют положительную основу (ядро), вокруг которой расположены отрицательно заряженные электроны. Наружная оболочка последних бывает недостроенной, а завершенная структура устойчивее, она включает восемь электронов.

Создание связи за счет общих пар электронов приводит к благоприятному состоянию атомов.
Максимальная В. — это величина Э. во внешней оболочке атома. Химические связи составляют Э., находящиеся на наружной оболочке атома. Изучив таблицу Менделеева, можно определить, что положение веществ в периодической системе и его В. взаимосвязаны.
Валентность:
- Высшая. Соответствует порядковому № группы.
- Низшая. От числа вида по табличным данным отнимают номер интересующего элемента.
Основанием для образования соединений является прием электронов.
Виды электронов:
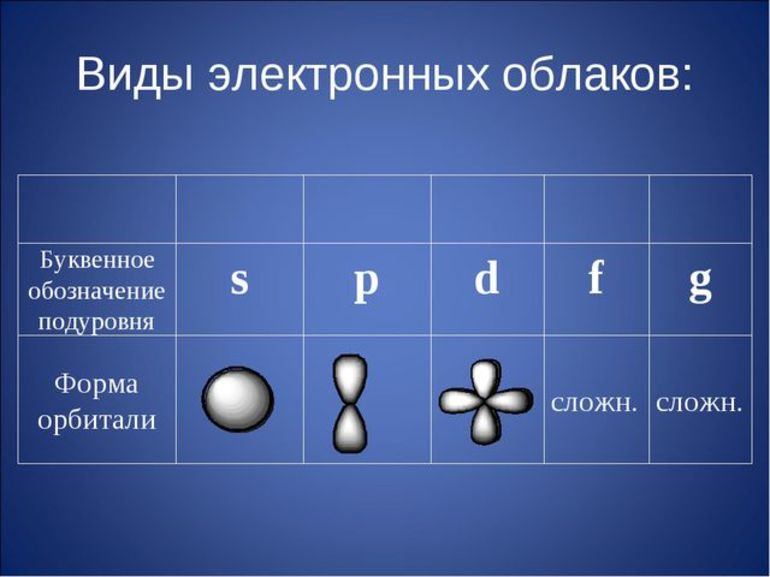
- Спаренные. Расположены на одной орбитали.
- Неспаренные. Это 1 электрон на орбитали.
В молекулярной структуре водорода и серы H2S последнее вещество приобретает двойную валентность (-), потому что каждый атом участвует в образовании 2 электропар. Знак черточка или тире указывает на притяжение пары к более отрицательному элементу. У менее отрицательного к валентности добавляют знак плюс.
Распределение свойств
В периодической таблице указаны все 118 химических элементов (водород, литий, бор, натрий, магний, кальций, ванадий, уран и другие).
Химические и физические свойства каждого вещества похожи с предшествующим ему в таблице элементом. Закономерность проявляется у всех, кроме нескольких первых, потому что они не включают перед собой элементов, аналогичных по атомному объему.
Валентность металлов:
| Элемент | В |
| Серебро | I-III |
| Ртуть | I-II |
| Золото | I-III |
| Никель | I- IV |
| Мышьяк | -III, II, III, V |
| Свинец | II-IV |
| Кобальт | II-IV |
| Олово | II, IV |
В периодической таблице элементы классифицированы, упорядочены с учетом атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды называются периодами, а столбцы — группами. В самой первой таблице содержалось не более шестидесяти элементов, теперь продолжительность списка увеличили до 118 элементов. Систематизированы не только химические вещества, но и их свойства.
Достаточно ученому-химику взглянуть на таблицу, и он сможет ответить на разные экзаменационные, научные вопросы.
Говоря о степени окисления, предполагают, что атом в веществе ионной природы имеет заряд, и если валентность нейтральная, то уровень окисления будет нулевым, положительным или отрицательным. Узнать информацию можно из таблицы Менделеева.
Для атома одного и того же Э., в зависимости от элементов, с которыми он сформирует химическое соединение, В. и стадия окисления совпадают (Н2О, СН4) и различаются (Н2О2, HNO3). Само понятие валентности ученые-химики не используют по Менделеевской таблице.
Валентность химических элементов
В образовании новых химических связей участвуют неспаренные электроны внешнего энергетического уровня. Именно они, как правило, определяют валентностъ элемента.
■ Валентность — это способность атомов химических элементов образовывать химические связи с другими атомами.

Валентность выражается числом атомов одновалентных элементов, которое атом данного элемента может замещать или присоединять во время образования определенного химического соединения. Валентность — свойство элемента, проявляемое в соединениях. Валентность обозначают римскими цифрами, она может составлять от I до VIII.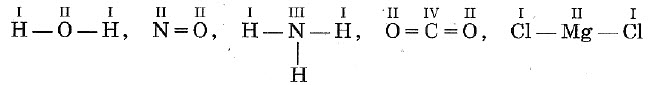
Существуют одновалентные (Н, Li, Na, K, F, Br), двухвалентные (Mg, Ca, Ba, O, S), трехвалентные (Al, N, P), четырехвалентные (C, Si) и т. п. элементы. Понятно, что один атом двухвалентного элемента соединяется с двумя атомами одновалентного элемента (CaCl2, Н2О), но с одним атомом двухвалентного атома (CaO). Атом трехвалентного элемента соединяется с тремя атомами одновалентного элемента FeCl3), два атома — трехвалентного (AlN).
Существуют атомы, имеющие постоянную (Na, K, Ca, Al, О) и переменную валентности. Например, валентность серы бывает II, IV и VI:
Как определять валентность, составлять химические формулы по валентности читайте в следующем конспекте «Определение валентности + Примеры»
Рассмотрев электронно-графические формулы элементов, можно определить, что валeнтность атома водорода равна I (имеет один неспаренный электрон). По одному неспаренному электрону у лития, фтора, натрия, калия. Эти атомы тоже одновалентны. Магний двухвалентен, т. к. у него два неспаренных электрона. У атомов гелия, неона и аргона все электроны спарены и отсутствуют свободные орбитали. Эти элементы химически инертны, то есть обладают нулевой валентностью.
Однако химические элементы в соединениях далеко не всегда проявляют валентность, соответствующую количеству неспаренных электронов в основном состоянии атома. Например, углерод может проявлять валентность IV (CO2).
Возможность проявлять ту или иную валентность зависит также и от количества свободных орбиталей на внешнем электронном слое атома: при наличии незанятых электронами р-орбиталей один из спаренных s-электронов может переходить на свободную р-орбиталь (при условии получения определенной порции дополнительной энергии извне).
Состояние атома, при котором электроны переходят с одной орбитали на другую в пределах одного энергетического уровня, называется возбужденным.
Пример. Рассмотрим атом углерода в основном и возбужденном состояниях (значком * обозначается возбужденное состояние атома):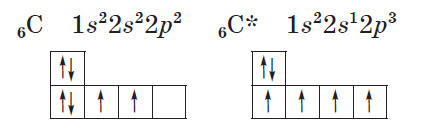
В основном состоянии атом углерода имеет два неспаренных электрона на р-подуровне; при переходе атома в возбужденное состояние один из двух электронов s-подуровня может переходить на свободную р-орбиталь. Количество неспаренных электронов в возбужденном состоянии увеличится до четырех. Валентность углерода при этом также изменится с двух до четырех.
Если в атомах нет свободных орбиталей (например, у кислорода или фтора), то разъединить электронные пары в этом случае невозможно. Поэтому вaлентность этих элементов будет совпадать с количеством неспаренных электронов: кислород двухвалентен, фтор одновалентен.
Конспект урока «Валентность химических элементов».
Следующая тема: «Определение валентности + Примеры»
Изотопы
Всего известно 34 изотопа и еще девять изомеров ядра . Четыре из них, 84 Sr, 86 Sr, 87 Sr и 88 Sr, встречаются в природе. В природном изотопном составе преобладает изотоп 88 Sr с долей 82,58%. 86 Sr с 9,86% и 87 Sr с 7,0% и 84 Sr с долей 0,56% встречаются реже.
90 Sr представляет собой бета-излучатель с энергией распада 0,546 МэВ и распадается до 90 Y с периодом полураспада 28,78 лет , который, в свою очередь, быстро ( t 1/2 = 64,1 ч ) испускает бета-излучение высокой энергии ( ZE = 2,282 МэВ) и распадается от гамма-излучения до стабильного 90 Zr. В основном это происходит как вторичный продукт расщепления . Она формируется в течение нескольких минут через многочисленные бета — распады от первичных продуктов деления массового числа 90, которые происходят в 5,7% от всех деления ядер из U в атомных электростанциях и атомных взрывах бомб . Это делает 90 Sr одним из наиболее распространенных продуктов деления.
- 92235U+1п⟶ 92236U⟶ 57144Л.а+35 год90Б.р+2 1п{\ displaystyle \ mathrm {^ {235} _ {\ 92} U + _ {0} ^ {1} n \ longrightarrow _ {\ 92} ^ {236} U \ longrightarrow _ {\ 57} ^ {144} La + _ {35} ^ {90} Br + 2 \ _ {0} ^ {1} n}}
- 92235U+1п⟶ 92236U⟶ 56143Б.а+3690Kр+3 1п{\ displaystyle \ mathrm {^ {235} _ {\ 92} U + _ {0} ^ {1} n \ longrightarrow _ {\ 92} ^ {236} U \ longrightarrow _ {\ 56} ^ {143} Ba + _ {36} ^ {90} Kr + 3 \ _ {0} ^ {1} n}}
- 35 год90Б.р →1,91 sβ- 3690Kр →32,32 sβ- 3790Р.б →158 sβ- 3890С.р →28 год,78 аβ- 3990Y →64, ЧАСβ- 4090Zр{\ displaystyle \ mathrm {^ {90} _ {35} Br \ {\ xrightarrow {\ beta ^ {-}}} \ _ {36} ^ {90} Kr \ {\ xrightarrow {\ beta ^ {-}}} \ _ {37} ^ {90} Rb \ {\ xrightarrow {\ beta ^ {-}}} \ _ {38} ^ {90} Sr \ {\ xrightarrow {\ beta ^ {-}}} \ _ { 39} ^ {90} Y \ {\ xrightarrow {\ beta ^ {-}}} \ _ {40} ^ {90} Zr}}
При всех ядерных катастрофах в окружающую среду попадает больше 90 Sr. Авариями, в результате которых в окружающую среду было выброшено 90 Sr, были пожар в Виндскейле , при котором было выделено 0,07 ТБк 90 Sr, и чернобыльская катастрофа , при которой активность выброса 90 Sr составила 800 ТБк. После наземных испытаний ядерного оружия , особенно в 1955–58 и 1961–63 годах, загрязнение атмосферы 90 Sr резко возросло. Это, наряду с зарядом 137 Cs в 1963 году, привело к принятию Договора о запрещении испытаний ядерного оружия в атмосфере, в космосе и под водой , который запретил такие испытания в подписавших его государствах. В результате в последующие годы загрязнение атмосферы снова значительно снизилось. Общая активность по 90 Sr выпущен ядерного оружия составляла приблизительно 6 · 10 17 Бк (600 ПБк).
Прием 90 Sr, который может попасть в организм через зараженное молоко, опасен. Бета-излучение высокой энергии изотопа может изменять клетки в костях или костном мозге и, таким образом, вызывать опухоли костей или лейкоз . Декорпорации захваченного в костном стронций с хелатирующими агентами невозможно, так как кальций этого предпочтительного комплекса и стронция в костных остатков. Декорпорация сульфатом бария возможна только в том случае, если она выполняется быстро после инкорпорации, прежде чем он может быть включен в кость. Деградация через биологические процессы также очень медленно, биологический период полураспада в костях составляет 49 лет, то в в 90 Sr составляет 18,1 лет. Возможно, 90 Sr связывается с клетками паращитовидных желез . Это позволит уменьшить накопление случаев гиперпаратиреоза в ликвидаторах в реакторе в Чернобыле объяснить.
Используется бета-излучение 90 Sr и 90 Y в радионуклиде , например, для удаленных радиомаяков и радиомаяков в бывшем Советском Союзе , используется маркировка долгоживущими изотопами , для измерения толщины материалов или для калибровки со счетчиков Гейгера .
87 Sr — продукт распада изотопа рубидия 87 Rb , период полураспада которого составляет 48 миллиардов лет . Таким образом, возраст пород, содержащих рубидий и стронций, таких как гранит, может быть определен по соотношению различных изотопов стронция в контексте изотопного анализа стронция .
Стронций в разных количествах хранится в костях и зубах в разных условиях . В то же время изотопное соотношение 86 Sr и 87 Sr зависит от пород в районе. Поэтому иногда можно сделать выводы о миграции доисторических людей из соотношений изотопов стронция.
По словам оператора, небольшой немецкий реактор с галечным слоем под названием AVR, расположенный рядом с исследовательским центром в Юлихе , считается самым сильно загрязненным 90 Sr ядерным объектом в мире. В полу под реактором также есть стронций. Его следует кропотливо удалить, когда реактор будет демонтирован к 2025 году.
Вхождение
Стронций содержится в таких минералах , как целестин SrSO 4 и стронцианит SrCO 3 .
Уровень присутствия стронция в земной коре низкий (0,034%). Некоторые соединения (растворимые) присутствуют в морской воде и некоторых источниках ( минеральная вода ).
Из радиоактивного стронция ( 90 Sr ) и цезия радиоактивные ( 137 Cs ) были загрязнены в биосферу в результате ядерных испытаний в воздухе, и в результате аварии на Чернобыльской АЭС (стронций был главным загрязнителем пульт дистанционного управления с ‘ йода и цезия ) и Фукусима .
Часть этого стронция повторно сконцентрирована в пищевой цепи , в частности, через определенные грибы. Опубликован аналитический метод стандартизации анализа стронция в грибах после прохождения чернобыльского облака .
Выщелачивание стронция и / или его биоконцентрация в пищевой сети означает, что загрязнение воды и воздуха быстро уменьшилось , согласно UNSCAR (в 2009 году питьевая и ирригационная вода больше не превышала 1 беккерель цезия и стронция на литр).
Влияние стронция на здоровье
Химические реакции могут сделать соединения стронция водорастворимыми, которые в этой форме представляют большую угрозу для здоровья человека. Водорастворимый стронций содержится в питьевой воде, но, к счастью, только в очень низких концентрациях.
Люди могут проглатывать небольшие количества (радиоактивного) стронция, вдыхая стронциевую пыль, через пищу, через питьевую воду или через контакт кожи с почвой, загрязненной стронцием. При попадании внутрь стронций био аккумулируется в организме. Продукты с высоким содержанием стронция включают зерновые, листовые овощи и молочные продукты.
Единственное соединение стронция, которое действительно опасно даже в малых концентрациях — это хромат стронция. Это связано с содержащимся в нем токсичным хромом. Хромат стронция может вызвать рак легких. Однако, поскольку существуют строгие правила безопасности в отношении его выпуска, он на самом деле не представляет серьезного риска для человека.
Потребление стронция в высоких концентрациях обычно не рассматривается как особый риск для здоровья человека. Соли стронция не вызывают сыпи или других проблем с кожей. Однако чрезмерно высокое потребление может вызвать нарушение развития костей. Однако это происходит только тогда, когда речь идет о концентрациях в диапазоне 1000 ppm, которые в обычных условиях никогда не могут появиться в пище и питьевой воде.
С другой стороны, радиоактивный стронций гораздо чаще влияет на здоровье, чем стабильный стронций. Если его поглощение очень высокое, в результате повреждения генетического материала может развиться анемия и недостаток кислорода, а при экстремальных концентрациях даже рак.
Общая характеристика металлов
Периодическая система — совокупность горизонтальных рядов и вертикальных столбцов. Последние включают в себя подгруппы А (главные) и В (побочные). Элементы подгрупп расположены друг под другом, они похожи по строению и свойствам. Типичные металлы относятся к первым трем А-группам.
Рис. 1. Периодическая система
Мысленно проведем диагональ в ПС: сверху от лития и бериллия вниз — к астату (Рисунок 1). Слева внизу окажутся элементы-металлы, справа вверху расположены неметаллы. Чем левее и ниже, тем сильнее металлические свойства. По направлению вверх и вправо усиливается неметаллический характер элементов. Вблизи воображаемой линии расположены металлоиды, сочетающие свойства двух классов элементов. Их соединения также обладают двойственным характером.
В атомах химических элементов первых трех А-групп расположены 1–3 электрона на внешнем (валентном) энергетическом уровне. До его заполнения не хватает 7–5 электронов. Таким частицам легче отдать валентные электроны, чем присоединить недостающие. При этом образуются ионы с зарядами от +1 до +3 (одно-трехзарядные катионы). Типичные валентности металлов — от I(+) до III(+), степени окисления — от + до 3+. Металлы В-групп могут отдавать электроны предвнешнего уровня. Валентности, степени окисления и заряды ионов в этом случае возрастают.
Радиусы металлов сравнительно большие, что тоже объясняет слабую связь внешних электронов с ядром. Закономерное возрастание радиусов наблюдается в группах сверху вниз. Также в этом направлении усиливаются металлические (восстановительные) свойства. Слева направо в периодах металлические свойства ослабевают, а неметаллические — усиливаются.
Низкие значения относительной электроотрицательности, малое сродство к электрону — еще одна общая черта металлов. В целом, это сильные восстановители, для которых нехарактерны окислительные свойства. В химических реакциях атомы металлических элементов легко отдают внешние электроны окислителям, при этом приобретают электронное строение инертного газа из предыдущего периода.
Сходством электронного строения обусловлены физические свойства металлов. (Рис. 2).
Рис. 2. Связь положения металлов со строением и свойствами
Наличием свободных электронов в виде «электронного газа» обусловлена высокая электропроводность металлов. Они обычно имеют светло- или темно-серый цвет, обладают характерным блеском. Это ковкие, пластичные вещества, что используются при изготовлении проволоки, проката. Теплопроводность и электропроводность металлов имеют большое практическое значение.
Кристаллическая решетка металлов отличается от других типов наличием «электронного газа». Щелочные металлы — самые мягкие, они легко сгибаются, режутся ножом.. Хром царапает стекло, что характерно для твердых веществ, например, алмаза, корунда. Самый легкий металл — литий, тяжелый – осмий. Ртуть плавится при 30°С, вольфрам — почти при 3400°С.
Восстановительные свойства металлов представлены в их последовательности, получившей название «Электрохимический ряд напряжений ( ряд активности металлов )». (Рис. 3).
Рис. 3. Ряд активности металлов
Слева направо в ЭХРН восстановительная активность металлы, а именно способность отдавать электрон, снижается.
Металлы реагируют с кислородом с получением оксидом. С водородом образуют гидриды (только металлы IА и IIА групп), с серой — сульфиды. Металлы вступают в химические реакции с галогенами и азотом.
Щелочные и щелочноземельные металлы реагируют с водой с образованием растворимых оснований. В реакции выделяется водород, который нередко вспыхивает из-за выделения тепла в результате взаимодействия веществ.
Металлы, расположенные в ЭХРН до водорода, вытесняют Н2 из растворов кислот. Металлы после водорода — менее активные. Медь, ртуть, золото, серебро и платина не взаимодействуют с кислотами с вытеснением Н2.
Более активные металлы могут вытеснять металлы, расположены в ЭХРН правее, из растворов солей. Это и другие свойства широко используются для получения металлов, их важнейших соединений.
Стронций-90
Стабильные изотопы стронция сами по себе малоопасны, но радиоактивные изотопы стронция представляют собой большую опасность для всего живого. Радиоактивный изотоп стронция стронций-90 по праву считается одним из наиболее страшных и опасных антропогенных радиационных загрязнителей. Связано это прежде всего с тем что он имеет весьма короткий период полураспада — 29 лет, что обуславливает очень высокий уровень его активности и мощное радиоционное излучение, а с другой стороны его способностью эффективно метаболизироваться и включаться в жизнедеятельность организма.
Стронций является почти полным химическим аналогом кальция, поэтому проникая в организм он откладывается во всех содержащих кальций тканях и жидкостях — в костях и зубах, обеспечивая эффективное радиационное поражения тканей организма изнутри. Стронций-90, а также образующийся при его распаде дочерний изотоп иттрий-90 (с периодом полураспада 64 часа, излучает бета-частицы) поражают костную ткань и, самое главное, особо чувствительный к действию радиации костный мозг. Под действием облучения в живом веществе происходят химические изменения. Нарушаются нормальная структура и функции клеток. Это приводит к серьезным нарушениям обмена веществ в тканях. А в итоге развитие смертельно опасных болезней – рака крови (лейкемия) и костей. Кроме того, излучение действует на молекулы ДНК и влияет на наследственность.
Стронций-90 легко передается по пищевым цепям биосферы, передавая заражение на большие расстояния. Так стронций-90, освободишвийся например в результате техногенной катострофы, попадает в виде пыли в воздух, заражая землю и воду, оседает в дыхательных путях людей и животных. Из земли он попадает в растения, продукты питания и молоко, а далее и в организм людей принявших зараженные продукты. Cтронций-90 не только поражает организм носителя, но и сообщает его потомкам высокий риск врожденных уродств и дозу через молоко кормящей матери.
Стронций-90 активно участвует в обмене веществ у растений. В растения стронций-90 попадает при загрязнении листьев и из почвы через корни.Особенно много стронция-90 накапливают бобовые, корне- и клубнеплоды и злаки. В организме человеке радиоактивный стронций избирательно накапливается в скелете, мягкие ткани задерживают менее 1% исходного количества. С возрастом отложение стронция-90 в скелете понижается, у мужчин он накапливается больше, чем у женщин, а в первые месяцы жизни ребенка отложение стронция-90 на порядок, а Sr на два порядка выше, чем у взрослого человека.
Совокупность свойств стронция-90 приводит его наряду с цезием-137 и радиоактивными изотопами иода в разряд самых опасных и страшных радиоктивных загрязнителей. Радиоактивный стронций может поступать в окружающую среду в результате ядерных испытаний и аварий на АЭС. При крупных ядерных испытаниях выход стронция-90 можед достигать 3,5%, а небольшие количества стронция-90, образующиеся в ядерных реакторах, из-за дефектов в оболочке твэла могут поступать в теплоноситель, а затем при его очистке попадать в жидкие и газообразные отходы.
При работах с радиоактивным стронцием (например в составе источников радиоактивных излучений) требуется большая осторожность. Для категории А допустимая концентрация стронция-90 в воздухе рабочей зоны составляет 4,4*10−2 Бк/л, допустимое содержание в костях ДСа 7,4*104 Бк, в легких 2,8*104 Бк.
Примечания
- Редкол.:Зефиров Н. С. (гл. ред.) Химическая энциклопедия: в 5 т. — Москва: Большая Российская энциклопедия, 1995. — Т. 4. — С. 441. — 639 с. — 20 000 экз. — ISBN 5—85270—092—4
- Стронций на Integral Scientist Modern Standard Periodic Table — www.qivx.com/ispt/elements/ptw_038.php
- J.P. Riley and Skirrow G. Chemical Oceanography V. I, 1965
- Рубидий — Свойства химических элементов — chem100.ru/elem.php?n=37
- NR2.Com.Ua: Пермская область. Пермские месторождения стронция могут вызвать снижение мировых цен на это полезное ископаемо / 22.08.00 / Новый Регион — Россия — www.nr2.com.ua/rus/16_11390.html
- ↑ 12 Токсикологические данные стронция — www.atsdr.cdc.gov/toxprofiles/tp159.html
история
Хэмфри Дэви
Первые признаки существования элемента нашли Адэр Кроуфорд и Уильям Круикшанк в 1790 году, когда она была минералом , полученным из Стронтиана в Шотландии , первым для «содержащего воздух барита» ( карбонат бария , по утверждениям Витерита ), исследованных более внимательно. . Они произвели хлорид и сравнили несколько свойств более позднего хлорида стронция со свойствами хлорида бария. Среди прочего, они определили различную растворимость в воде и других кристаллических формах. В 1791 году минерал назван Фридрихом Габриэлем Зульцером (1749–1830) в честь его места Стронтиан Стронтианит . Он и Иоганн Фридрих Блюменбах более внимательно изучили минерал и обнаружили другие отличия от витерита, такие как различная токсичность и цвет пламени . В последующие годы химики, такие как Мартин Генрих Клапрот , Ричард Кирван , Томас Чарльз Хоуп или Иоганн Тобиас Ловиц, продолжали изучать стронцианит и извлекать из него другие соединения стронция.
В 1808 году Хамфри Дэви удалось произвести амальгаму стронция путем электролитического восстановления в присутствии красного оксида ртути , который он затем очистил дистилляцией и таким образом получил — хотя и все еще загрязненный — металл. Он назвал его в честь стронцианита, аналогичного стронцию других щелочноземельных металлов . Роберт Бунзен получил чистый стронций в 1855 году электролизом расплава хлорида стронция. Это также определило свойства металла, такие как удельный вес элемента.
Примечания и ссылки
- ↑ and (en) Дэвид Р. Лид, Справочник CRC по химии и физике , CRC Press Inc,2009 г., 90- е изд. , 2804 с. , Твердый переплет ( ISBN 978-1-420-09084-0 )
- (in) Беатрис Кордеро Вероника Гомес, Ана Э. Платеро-Пратс, Марк Ревес Хорхе Эчеверрия, Эдуард Кремадес, Флавиа и Сантьяго Барраган Альварес , Новый взгляд на ковалентные радиусы , Dalton Transactions ,2008 г., стр. 2832 — 2838 ( DOI )
- Манджера Мантина, Адам С. Чемберлин, Розендо Валеро, Кристофер Дж. Крамер, Дональд Г. Трулар: Согласованные радиусы Ван-дер-Ваальса для всей основной группы. В: J. Phys. Chem. . 2009, 113, S. 5806–5812, .
- База данных Chemical Abstracts запрошена через SciFinder Web 15 декабря 2009 г. ( результаты поиска )
- ↑ и
- MASCANZONI D. (Шведские сельскохозяйственные науки, отдел радиоэкологии, Упсала ); «Определение 90Sr и 137Cs в грибах после аварии на Чернобыльской АЭС» ; Журнал радиоаналитической и ядерной химии; ( ISSN ) ; MARC-II: международная конференция по методам и применению радиоаналитической химии №2, Kona HI, США (21.04.1991) Американское ядерное общество. Тематическая конференция, Kona HI, США (21.04.1991) 1992, т. 161, № 2 (305 с)
- JL Harley, «Значение микоризы» . Mycological Research 1989. 92: 129-134.
- GJD Кирк и С. Стонтон. О предсказании судьбы радиоактивного цезия в почве под лугами . Journal of Soil Science, 1989. 40: 71-84.
- ↑ и
- ↑ и
- Rosenthal, HL (1969) Накопление стронция-90 из окружающей среды в зубах детей . Материалы девятого ежегодного симпозиума по биологии в Хэнфорде, Ричленд, Вашингтон, Вашингтон, округ Колумбия, 5-8 мая 1969 г., Комиссия по атомной энергии США
- ↑ и (in) Стивен Г. Хиббинс, Кирк-Отмер Энциклопедия химической технологии, 4-е изд. : Стронций и соединения стронция , т. 22, John Wiley & Sons.
- ANSM, Коммюнике, , 2011-10-07, консультации проведены 14 марта 2013 года.
- обновлено 3 апреля 2012 г., консультация 14 марта 2013 г.
- Янг, П.С., Грир, AIM, Цимбури, депутат, Мик, Р.Д., Гадегаард, Н., и Далби, MJ (2017). СТРОНЦИОНАЛЬНЫЕ НАНОТОПОГРАФИЧЕСКИЕ ПОВЕРХНОСТИ ДЛЯ КОНТРОЛЯ ГОМЕОСТАЗА КОСТИ. Костный сустав J, 99 (SUPP 18), 2-2.
- Сырбу, П.Д., Тюдор, Р., Веринга, В., Чиунту, Б.М., Раду, В., Чубара, Б., и Бадулеску, О.В. (2017). Стронций ранелат в лечении переломов, осложненных задержкой сращения. Это действительно эффективно? . REVISTA DE CHIMIE, 68 (8), 1825-1828.
Ресурсные провинции
За рубежом стронций добывается из собственно стронциевых месторождений, нередко с примесью бария, где руда представлена или сульфатом стронция – целестином, или карбонатом стронция – стронцианитом. Крупными месторождениями целестина с запасами в миллионы тонн располагают Испания, Турция, Иран, Китай, Мексика, Канада. Стронцианит добывают на юго-востоке Африки, в Малави.
В России тоже имеются собственно стронциевые (преимущественно целестиновые) месторождения. Вместе со стронцием часто присутствует барий. Прогнозные ресурсы по оксиду стронция на 01.01.2007 года оценивались в 161 млн. тонн. Наиболее перспективные по содержанию стронция и технологическим свойствам целестиновые руды выявлены на месторождении Синие камни в горах Дагестана, среди известняков верхнеюрского-мелового возраста. Руды содержат от 10 до 18% оксида стронция, хорошо обогащаются. Разведанные запасы составляют 680 тыс. тонн. Район весьма перспективен для дальнейшей разведки. Однако сложная геополитическая обстановка мешает освоению месторождения.
В Пермской области, у деревни Мазуевка, разведано Мазуевское месторождение целестина. Содержание оксида стронция – от 2 до 32%. Балансовые запасы – 270 тыс. тонн, забалансовые – около 1,5 млн. тонн, прогнозные – до 7 млн. тонн. По экономическим показателям Мазуевское месторождение является наиболее перспективным для разработки.
Крупные месторождения целестина известны также в Центральной России, в Тульско-Рязанской провинции, среди доломитов и известняков верхнего девона. Здесь, в Кимовском районе Тульской области, предварительно разведано очень крупное Табольское месторождение с запасами до 3 млн. тонн целестина, с содержанием в рудах 5–6% оксида стронция, без вредной примеси бария. Руды хорошо обогащаются, но добыча должна быть комплексной – с использованием попутно добываемого известняка и доломита.
Месторождения стронция обнаружены также в Бурятии, на Мурунском горном массиве в Иркутской области, в Красноярском крае и Якутии. Здесь накопление стронциевых минералов происходило не в осадочных породах, а в различных типах глубинных пород – карбонатитах, сиенитах, базальтах.
Разведанные запасы оксида стронция достигают здесь сотен тысяч тонн при довольно высоком качестве руды и также могут использоваться в местной металлургической промышленности – для Кузнецкого и Западно-Сибирского металлургических комбинатов. В частности, последний выпускает 70% железнодорожных рельсов России. В Иркутске действует завод тяжелого машиностроения (ИЗТМ), производящий для Сибири драги и навесное оборудование для бульдозеров. Как пригодилась бы морозостойкая стронциевая сталь в сибирские морозы!
Химические свойства
Файл:Горящий стронций.jpg
Горящий стронций
Стронций отличается большой химической активностью, по химическим свойствам сходен с Са и Ва. Стандартный электродный потенциал Sr2+/Sr° — 2,89В. При обычных температурах металличесский стронций взаимодействует с воздухом, покрываясь пленкой из SrO и SrO2, при нагревании воспламеняется. Энергично реагирует с водой с образованием Sr(OH)2 и выделением водорода. При взаимодействии с галогенами образует галогениды. С СО2 реагирует при повышенных температурах: 5Sr + 2СО2 → SrC2 + 4SrO). При нагреве до 300-400°С реагирует с водородом, образуя гидрид SrH2, при нагреве с серой, селеном и теллуром — соответственно сульфид SrS, селенид SrSe и теллурид SrTe, с азотом — нитрид Sr3N2, с углеродом — карбид SrC2, с газообразным аммиаком — амид Sr(NH2)2 и т.д. В расплавленном состоянии стронций образует однородные расплавы (растворы) со многими металлами, с кальцием и барием дает непрерывный ряд твердых растворов, образует интерметаллиды, например SrAl, SrAl4, SrMg2. Стронций растворяется в разбавленных кислотах с образованием солей и выделением водорода. Реакция стронция с концентрированной серной кислотой приводит к образованию SrSO4, SO2, H2S и S, c концентрированной HNO3 — Sr(NO3)2 и NO. При растворении стронция в жидком аммиаке может быть получен аддукт Sr(NH3)6. Хорошо растворимы в воде хлорид, бромид, иодид, ацетат и некоторые другие соли стронция, плохо растворимы сульфат, фторид, карбонат, оксалат, арсенит, хромат, иодат, фосфат, молибдат.
Физические свойства
Файл:Металический стронций.jpg
Металический стронций
Стронций — мягкий серебристо-белый металл, ковкий и пластичный. В неочищенном состоянии окрашен в желтый цвет. Существует в трех полиморфных модификациях:
1. До 231°С устойчив α-Sr с кубической гранецентрированной решеткой типа Cu (а = 0,6085 нм, z = 4, пространственная группа Fm3m, плотность 2,63 г/см3).
2. При температурах 231-623°C существует β-Sr с гексагональной решеткой типа Mg (а = 0,431 нм, с = 0,705 нм, z = 2, пространственная группа Р63/mmc).
3. Выше 623°C существует γ-Sr с кубической объемно-центрированной решеткой типа α-Fe (а = 0,485 нм, z = 2, пространственная группа Im3m).
Температура плавления стронция — 768°С ; температура кипения 1390°С; изобарная теплоемкость 26,79 Дж/(моль*К); стандартная теплота плавления 8,2 кДж/моль, стандартная теплота испарения 133,8 кДж/моль, стандартная теплота возгонки 160,5 кДж/моль; стандартная энтропия 55,70 Дж/(моль*К); давление пара 2,254*10−6 Па (при 500К), 2,861*10−4 Па (при 580К), 1,12*10−2 Па (при 660К), 245,9 Па (при 1043К); температурный коэффицент линейного расширения 20,6*10−6K−1 (в интервале 273-503К), 22,6*10−6K−1 (в интервале 503-773К); электрическое сопротивление 0,2 мкОм*м (при 0°С), 21,5 мкОм*м (при 22°С), 60 мкОм*м (при 400°С), температурный коэффицент электрического сопротивления 5,2*10−3K−1 (в интервале 273-473К); парамагнетик, удельная магнитная восприимчивость +1,05*10−9; γ 350 мН/м (при 768°С). Пластичен, модуль упругости 16,0 ГПа, модуль сдвига 6,08 ГПа; σраст 49,0 МПа (при 20°С), 53,9 МПа (при 110°С), 200 МПа (при 200°С), 1,0 МПа (при 700°С); твердость по Бринеллю 190 МПа (при 20°С), 90 МПа (при 200°С), 2,0 МПа (при 700°С); относительное удлинение 1,0% (при 20°С), 5,3% (при 200°С), 40% (при 700°С).









![Периодическая система элементов и структура электронной оболочки атомов [1972 семишин в.и. - периодическая система химических элементов д. и. менделеева]](http://mehanik35.ru/wp-content/uploads/0/9/1/0917a0a1d74a786a99ad47386e4eb7d7.jpeg)




















