Микроструктура и свойства
Каждой из фаз, характерных для железоуглеродистых сплавов, свойственно собственное строение решеток и зерен. Структура аустенита – пластинчатая, имеющая формы, близкие и к игольчатому виду, и к хлопьевидному. При полном растворении углерода в γ-железе, зерна имеют светлую форму без наличия темных цементитных включений.
Твердость составляет 170-220 НВ. Теплопроводность и электропроводность на порядок ниже, чем у феррита. Магнитные свойства отсутствуют.
Варианты охлаждения и его скорости приводят к образованию различных модификаций «холодного» состояния: мартенсита, бейнита, троостита, сорбита, перлита. Они имеют похожую игольчатую структуру, однако отличаются дисперсностью частиц, размером зерен и цементитных частиц.
Классификация железоуглеродистых сплавов
Классификация железоуглеродистых сплавов в зависимости от концентрации углерода в сплаве:
- C<0,025%. Техническое железо. При комнатной температуре будет состоять только из феррита;
- 0,025<C<2,14. Стали:
-
- 0,025<C<0,8. Доэвтектоидные стали. Состав: феррит + перлит (или третичный цементит);
- C=0,8. Эвтектоидная сталь. «Чистый» перлит;
- 0,8<C<2,14. Заэвтектоидная сталь. Состав: вторичный цементит + перлит;
- 2,14<C<6,67. Чугуны:
-
- 2,14<C<4,3. Доэвтектический чугун. Состав: ледебурит + перлит + вторичный цементит;
- C=4,3. Эвтектический чугун. «Чистый» ледебурит;
- 4,3<C<6,67. Заэвтектический чугун. Состав: ледебурит + цементит.
Техническое железо выделяет то, что оно состоит исключительно из феррита. Который и определяет его свойства: мягкость, чрезвычайную пластичность и т.д.
Чугуны же выделяет наличие ледебурита, придающего им хрупкость. Поэтому чугуны не могут подвергаться ковке. Зато обладают лучшими литейными свойствами (чем стали), обусловленными наличием легкоплавкого ледебурита.
Полиморфные превращения
Более подробно о каждой фазе чуть ниже в статье. А если кратко, то осуществление главных превращений происходит при особых температурах.
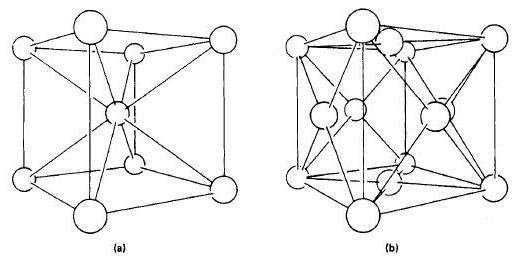
Состояние железа обозначают как α-феррум (при температуре менее 911° С) . Кристаллическая решетка – объемный гранецентрированный куб. Или ОЦК. Дистанция между атомами такой решетки достаточно высокая.
Железо приобретает модификацию гамма, то есть обозначается как γ-феррум (911-1392° С) . Кристаллическая решетка — гранецентрированный куб (ГЦК). В этой решетке дистанция между атомами ниже, чем в ОЦК.
При переходе α-феррума в γ-феррум объем вещества становится меньшим. Причиной тому является кристаллическая решетка – ее вид. Потому что решетка ГЦК имеет более упорядоченное состояние атомов, чем ОЦК.
Если переход осуществляется в обратном направлении — из γ-феррума в α-феррум, то объем сплава увеличивается.
Когда температура достигает значения 1392° С (но менее температуры плавления железа 1539° С), то α-феррум превращается в δ-феррум, но это не является ее новой формой, а лишь разновидностью. К тому же δ-феррум является неустойчивой структурой.
Образование аустенита
Образование аустенита при нагреве . Места преимущественного образования аустенита — на границе раздела фаз
феррит — цементит. В феррито-перлитной структуре превращение
в аустенит происходит сначала в перлитных объёмах. В грубопластинчатом перлите не только образование, но и рост аустенита может проходить
по поверхности раздела карбид — феррит.
До полного образования гомогенного аустенита во всём объёме, на каждом этапе превращения по мере повышения температуры в аустените могут
оставаться нерастворённые фазы.
На размер образующихся аустенитных зёрен влияют многие факторы (исходный размер зерна, характер исходной структуры, скорость нагрева,
температура аустенизации, характер плавки: степень раскисления, наличие неметаллических включений и др.).
Добавки легирующих элементов также оказывают различное влияние на образование аустенита.
Ход превращения феррито-карбидной структуры в аустенит (особенно в случае легирования стали стали карбидообразующим элементом)
происходит в три этапа:
- образование аустенита во всём объёме;
- растворение карбида;
- гомогенизация аустенита.
Диаграмма превращения аустенита: см. на странице Изотермическое превращение аустенита.
Влияние охлаждения на аустенит
Распад аустенита происходит в тех же критических точках. Результативность его зависит от следующих факторов:
- Скорость охлаждения. Влияет на характер углеродных включений, формирования зерен, образования итоговой микроструктуры и ее свойств. Зависит от среды, которая используется в качестве охладителя.
- Наличие изотермической составляющей на одном из этапов распада – при понижении до определенного температурного уровня, поддерживается стабильное тепло некоторый период времени, после чего продолжается быстрое охлаждение, или же оно происходит вместе с нагревательным устройством (печью).
Таким образом, выделяют непрерывное и изотермическое превращения аустенита.
Термообработка цветных металлов
Сплавы на основе других металлов не отвечают на закалку столь же ярко, как стали, но их твердость тоже можно повысить термообработкой. Обычно используют сочетание закалки и предварительного отжига (нагрева выше точки фазового превращения с медленным охлаждением).
- Бронзы (сплавы меди) подвергают отжигу при температуре чуть ниже температуры плавления, а потом закалке с охлаждением водой. Температура закалки от 750 до 950С в зависимости от состава сплава. Отпуск при 200-400С производят в течение 2-4 часов. Наибольшие показатели твердости, до HV300 (около HRC 34) можно при этом получить для изделий из бериллиевых бронз.
- Твердость серебра можно повысить отжигом до температуры, близкой к температуре плавления (тусклый красный цвет) с последующей закалкой.
- Различные сплавы никеля подвергают отжигу при 700-1185С, такой широкий диапазон определяется разнообразием их составов. Для охлаждения используют соляные растворы, частички которых потом удаляют водой либо защитные газы, препятствующие окислению (сухой азот, сухой водород).
| Металл | Температура отжига, C° | Охлаждающая среда |
| Медь Латунь Л96 Латунь Л90-Л62 Мельхиор Нейзильбер Серебро Алюминий Дюралюминий | 500 — 600 540 — 600 600 — 700 650 — 700 700 — 750 650 — 700 300 — 350 360 — 380 | Вода На открытом воздухе На открытом воздухе Вода Вода Вода На открытом воздухе Охлаждение в печи |
Применение аустенитных сталей
Наиболее частое использование:
- Любые элементы, которые используются при высоких температурах – более 200 градусов (вплоть до 1100). Это могут быть самолетные турбины или различные детали в двигателе. Однако следует внимательно следить за тем, какие химические реакции будут происходить при контакте с топливом, паром и другими агрессивными средами. Иногда возникают трещины. Чтобы предотвратить такую возможность, следует добавить такие примеси как ванадий и ниобий. С ними будет сформирована карбидная фаза, за счет чего происходит упрочнение поверхности.
- Различные механизмы, которые подвергаются быстрым температурным перепадам. Например, при сварке некоторых материалов.
- Электрическое оборудование, контакты. Их можно сделать благодаря тому, что аустенит устойчив к электромагнитным волнам.
- Детали для устройств, работающих в водной среде или в условиях повышенной влажности. Это возможно из-за коррозионной устойчивости. Никель и хром, которые способствуют этой характеристики, также продлевают износ элемента.
Фазы в системе “железо-углерод”
В системе железо – углерод существуют следующие фазы: жидкая фаза, феррит, аустенит, цементит, графит.
Жидкая фаза
Жидкая фаза. В жидком состоянии железо хорошо растворяет углерод в любых пропорциях с образованием однородной жидкой фазы.
Феррит
Феррит (Ф, α)- твердый раствор внедрения углерода в α-железе (от латинского слова ferrum – железо). Различают низкотемпературный феррит с предельной растворимостью углерода 0,02 % при температуре 727° С (точка P) и высокотемпературный δ-феррит (в интервале температур 1392…1539° С) с предельной растворимостью углерода 0,1 % при температуре 1499° С (точка J).
Свойства феррита близки к свойствам железа. Он мягок (твердость – 80 – 130 НВ, временное сопротивление – σв=300 МПа) и пластичен (относительное удлинение – δ=50 %), магнитен до 768° С.
Под микроскопом феррит выглядит как светлые полиэдрические зерна. В сталях может существовать в виде сетки (разной толщины, в зависимости от содержания углерода), зерен (малоуглеродистые стали), пластин или игл (видманштетт).
Аустенит в сталях
Аустенит (А, γ) – твердый раствор внедрения углерода в γ–железо (по имени английского ученого Р. Аустена). Углерод занимает место в центре гранецентрированной кубической ячейки. Предельная растворимость углерода в γ -железе 2,14 % при температуре 1147° С (точка Е). Аустенит имеет твердость 180 НВ, пластичен (относительное удлинение – δ=40…50 %), парамагнитен. При растворении в аустените других элементов могут изменяться свойства и температурные границы существования. Под микроскопом выглядит как светлые полиэдрические зерна с двойниками.
Цементит – формы существования
В железоуглеродистых сплавах присутствуют фазы: цементит первичный, цементит вторичный, цементит третичный. Химические и физические свойства этих фаз одинаковы. Влияние на механические свойства сплавов оказывает различие в размерах, количестве и расположении этих выделений. Цементит первичный выделяется из жидкой фазы в виде крупных пластинчатых кристаллов. Цементит вторичный выделяется из аустенита и располагается в виде сетки вокруг зерен аустенита (при охлаждении – вокруг зерен перлита). Цементит третичный выделяется из феррита и в виде мелких включений располагается у границ ферритных зерен.
Поскольку углерод в сплавах с железом встречается в виде цементита и графита, существуют две диаграммы состояния, описывающие условия равновесия фаз в системах железо – цементит и железо – графит. Первая диаграмма (Fе — Fе3С) называется цементитной (метастабильная), вторая (Fе – С) – графитной (стабильная). Оба варианта диаграммы приводятся вместе в одной системе координат: температура – содержание углерода. Диаграмма состояния системы железо – углерод построена по результатам многочисленных исследований, проведенных учеными ряда стран. Особое место среди них занимают работы Д.К. Чернова
Он открыл существование критических точек в стали, определил их зависимость от содержания углерода, заложил основы для построения диаграммы состояния железоуглеродистых сплавов в ее нижней, наиболее важной части
Буквенное обозначение узловых точек в диаграмме является общепринятым как в России, так и за рубежом.
Диаграмма состояния железо-углерод
Имеющиеся во всех областях диаграммы фазы видны на рисунке. Значение всех линий указано в таблице.
Ликвидус по всей диаграмме проходит по линиям АВ, ВС, СD; солидус – по линиям АН, НJ, JЕ, ЕСF. Сплавы железа с углеродом обычно делят на стали и чугуны. Условной границей для такого деления является 2,14 % С (точка E). Сплавы, содержащие углерода менее 2,14 %, относятся к сталям, более 2,14 % – к чугунам.
Температуры, при которых происходят фазовые и структурные превращения в сплавах системы железо – цементит, т.е. критические точки, имеют условные обозначения. Обозначаются буквой А. В зависимости от того, при нагреве или при охлаждении определяется критическая точка, к букве А добавляется индекс с (от слова chauffage – нагрев) при нагреве и индекс r (от слова refroidissement – охлаждение) при охлаждении с оставлением цифры, характеризующей данное превращение.
Таким образом, например, нагрев доэвтектоидной стали выше соответствующей точки на линии GS обозначается как нагрев выше точки АС3. При охлаждении же этой стали первое превращение должно быть обозначено как Аr3, второе (на линии РSК) – как Аr1.
Структуры на диаграмме железо-углерод
Напомним о 2 кристаллических формах железа:
- α-железо. Имеет объемноцентрированную кубическую (ОЦК) решетку;
- γ-желез. Имеет гранецентрированную кубическую (ГЦК) решетку.
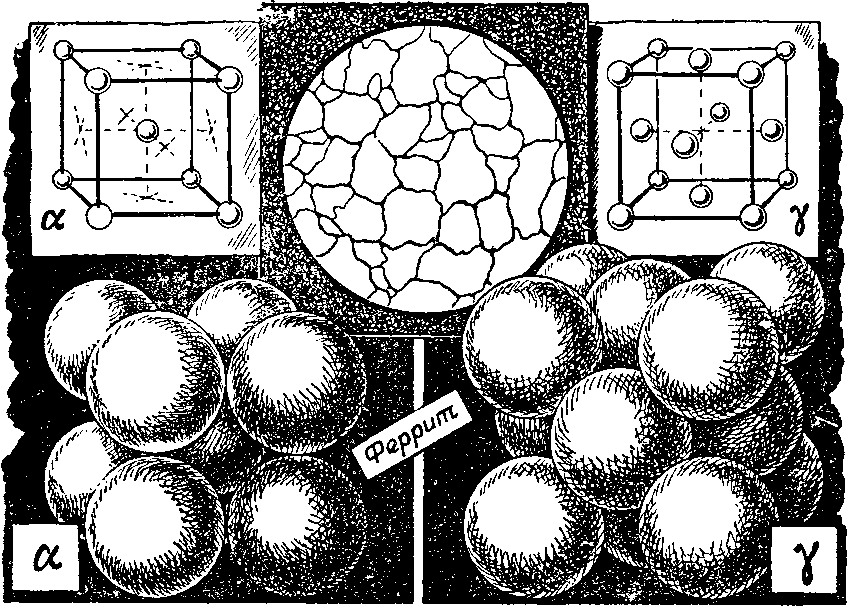
Кристаллическая решетка железа
Полиморфное превращение одной формы в другую при проведении термообработки сталей происходит при прохождении сплавами линии GSK.
Выделим 4 фазы в системе железо-углерод:
- Жидкая фаза. Концентрация углерода не ограничена;
- Феррит – это твёрдый раствор углерода в α-железе. Максимальная концентрация углерода – всего лишь 0,025% (точка P). При комнатной температуре – не выше 0,006%. Феррит мягок и пластичен.
- Аустенит – твёрдый раствор углерода в γ-железе. Максимальная концентрация углерода — 2,14 % (точка E). Аустенит имеет невысокую твёрдость, пластичен, не магнитится.
- Цементит — химическое соединение железа с углеродом (карбид железа, Fe3C). Концентрация углерода, соответственно, постоянная – 6,67 % углерода. Цементит очень твёрд, хрупок, непластичен.
В зависимости от условий образования выделяют:
- первичный цементит (образуется из жидкости);
- вторичный цементит (выделяется из аустенита вокруг его зерен);
- третичный цементит (выделяется из феррита по границам его зерен);
- эвтектоидный цементит (является составной частью перлита);
- эвтектический цементит (является составной частью ледебурита).
Необходимо так же выделить 2 структурные составляющие железоуглеродистых сплавов:
- Перлит (эвтектоид) – механическая смесь 2 фаз – пластинок/зерен феррита и цементита. Перлит образуется в результате перлитного превращения аустенита («свободного» или входящего в состав ледебурита) с концентрацией углерода 0,8% при прохождении ниже линии PSK:
А0,8→Ф0,025 + Ц6,67
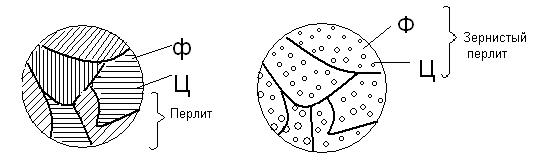
Структура перлита. Ф — феррит, Ц — цементит
Железо при этом переходит из γ-формы в α-форму. Механические свойства сильно зависят от размера (дисперсности) частичек, из которых состоит данный перлит.
- Ледебурит (эвтектика) – механическая смесь 2 фаз – пластинок/зерен аустенита и цементита. Ледебурит образуется из жидкой фазы с концентрацией углерода 4,3% при прохождении ниже линии ECF:
Ж4,3→А2,14 + Ц6,67
Структура ледебурита. Ц — цементит, А — аустенит.
Повторяясь, напомним, что при прохождении сплавов ниже линии PSK (727°С) аустенит, входящий в состав ледебурита, претерпевает перлитное превращение, разделяясь на феррит и цементит. Ледебурит тверд и хрупок.
При комнатной температуре железоуглеродистые сплавы могут иметь различную структуру, а значит и свойства, хотя и состоят всегда всего из 2 фаз: феррита и цементита.
ЗАПАСЫ И ДОБЫЧА
Железо — один из самых распространённых элементов в Солнечной системе, особенно на планетах земной группы, в частности, на Земле. Значительная часть железа планет земной группы находится в ядрах планет, где его содержание, по оценкам, около 90 %. Содержание железа в земной коре составляет 5 %, а в мантии около 12 %.

Железо
В земной коре железо распространено достаточно широко — на его долю приходится около 4,1 % массы земной коры (4-е место среди всех элементов, 2-е среди металлов). В мантии и земной коре железо сосредоточено главным образом в силикатах, при этом его содержание значительно в основных и ультраосновных породах, и мало — в кислых и средних породах.
Известно большое число руд и минералов, содержащих железо. Наибольшее практическое значение имеют красный железняк (гематит, Fe2O3; содержит до 70 % Fe), магнитный железняк (магнетит, FeFe2O4, Fe3O4; содержит 72,4 % Fe), бурый железняк или лимонит (гётит и гидрогётит, соответственно FeOOH и FeOOH·nH2O). Гётит и гидрогётит чаще всего встречаются в корах выветривания, образуя так называемые «железные шляпы», мощность которых достигает несколько сотен метров. Также они могут иметь осадочное происхождение, выпадая из коллоидных растворов в озёрах или прибрежных зонах морей. При этом образуются оолитовые, или бобовые, железные руды. В них часто встречается вивианит Fe3(PO4)2·8H2O, образующий чёрные удлинённые кристаллы и радиально-лучистые агрегаты.
Содержание железа в морской воде – 1·10−5-1·10−8 %
В промышленности железо получают из железной руды, в основном из гематита (Fe2O3) и магнетита (FeO·Fe2O3).
Существуют различные способы извлечения железа из руд. Наиболее распространённым является доменный процесс.
Первый этап производства — восстановление железа углеродом в доменной печи при температуре 2000 °C. В доменной печи углерод в виде кокса, железная руда в виде агломерата или окатышей и флюс (например, известняк) подаются сверху, а снизу их встречает поток нагнетаемого горячего воздуха.
Кроме доменного процесса, распространён процесс прямого получения железа. В этом случае предварительно измельчённую руду смешивают с особой глиной, формируя окатыши. Окатыши обжигают, и обрабатывают в шахтной печи горячими продуктами конверсии метана, которые содержат водород. Водород легко восстанавливает железо, при этом не происходит загрязнения железа такими примесями, как сера и фосфор, которые являются обычными примесями в каменном угле. Железо получается в твёрдом виде, и в дальнейшем переплавляется в электрических печах. Химически чистое железо получается электролизом растворов его солей.
Структура аустенита
Аустенит имеет г.ц.к. структуру γ-Fe. Структуре аустенита характерно следующее:
- Период решётки γ-Fe линейно возрастает от 0,3637 нм при 911°C до 0,368 нм при 1390°C.
- Углерод растворяется в γ-Fe в виде C4+ и занимает октапоры, образуя твёрдые растворы внедрения.
- С увеличением содержания углерода в аустените период решётки γ-фазы увеличивается.
Кристаллическую структуру аустенита можно представить себе как гранецентрированную решётку, состоящую из атомов железа, в которую
внедрены атомы углерода меньшего размера. Так как атом углерода больше размеров поры (свободного места в г.ц.к.-решётке), то при попадании
его в решётку железа последняя искажается и это делает остальные поры недоступными для других атомов углерода.
Структуру аустенита можно стабилизировать с помощью легирования, так как все элементы, которые растворяются в железе, влияют на
температурный интервал существования его аллотропических модификаций, в частности — аустенита.
Другими словами структура аустенита получается при высоком содержании в стали легирующего элемента (Ni, Mn и др.),
расширяющего область γ-фазы.
Дополнительно см. на странице Аустенитные стали.
Предназначение изотермического отжига и нормализации
 Изотермический отжиг применяется для высоколегированных и высокохромистых сталей. Его особенность заключается в нагреве металла на 30−50 градусов выше критической точки Ас3 и в ускоренном охлаждении до температуры выдержки ниже критической точки А1, а затем в естественном охлаждении на открытом воздухе.
Изотермический отжиг применяется для высоколегированных и высокохромистых сталей. Его особенность заключается в нагреве металла на 30−50 градусов выше критической точки Ас3 и в ускоренном охлаждении до температуры выдержки ниже критической точки А1, а затем в естественном охлаждении на открытом воздухе.
Данный вид дает несколько видимых преимуществ, первое из которых заключается во времени, то есть весь процесс — начиная от нагрева, выдержки и до остывания — занимает гораздо меньше времени, чем этап остывания детали вместе с печью. Второе преимущество состоит в том, что при изотермической выдержке и резком охлаждении достигается более сглаженная и однородная структура по сечению детали.
- Нормализация. Процесс нормализации осуществляется в качестве промежуточного перед обработкой и закалкой в целях устранения наклепа и внутреннего напряжения. Доэвтектоидная сталь подвергается нагреву до критической точки Ас3 на 30−50 градусов выше, постепенно охлаждается на открытом воздухе. Причем в отличие от отжига при нормализации происходит переохлаждение, за счет чего и достигается более однородная тонкая и мелкозернистая структура.
- Последствия нормализации. Значительно повышается прочность и ударная вязкость стали. Нормализация протекает гораздо быстрее, чем отжиг, а ее производительность намного выше. Поэтому рекомендуется нормализовать стали, содержащие в своем составе углерод, а не подвергать отжигу.
Газовая сварка аустенитных сталей
При аустенитных сталей рекомендуется выбирать ацетиленокислородное сварочное пламя мощностью 70-75 л/ч из расчёта на 1мм свариваемой толщины. Не рекомендуется применять окислительный , т.к. при его применении сильно выгорает хром. аустенитных сталей рекомендуется следующих марок: Св-02Х19Н9Т, Св-08Х19Н10Б. Также применяют другие марки проволоки с низким содержанием углерода, легированные титаном или ниобием. (1-6мм), диаметр проволоки выбирают равным диаметру основного металла.
Часто применяют , например, флюс марки НЖ-8. Компоненты флюса замешаны на жидком стекле и наносятся на сварные кромки изделия. Процесс сварки выполняют после полного высыхания флюса.
Сварку аустенитных сталей можно выполнять любыми , без ограничения. Состав присадочных материалов обычно выбирают аналогичным составу свариваемых сталей. Если требования к показателям коррозионной стойкости высокие, то уместным будет применение присадочного материала, не содержащего ферритной основы.
Аустенитные стали, обладая рядом особых свойств, применяются в тех рабочих средах, которые отличаются высокой агрессивностью. Такие сплавы незаменимы в энергетическом машиностроении, на предприятиях нефтяной и химической промышленности.
Роль границ аустенитных зерен
Когда аустенит превращается при охлаждении в какую-либо другую фазу, то эта новая фаза всегда сначала формируется или зарождается на старых границах зерен аустенита. Например, если перлитную сталь У8 сначала нагрели до полного аустенита при температуре 850 °С, а затем охладили на воздухе до 650 °С, то малые зерна перлита будут образовываться на старых границах аустенитных зерен сразу после того как температура упадет ниже 727 °С. Когда температура достигнет 650 °С, эти зерна начнут расти, но между ними еще будет оставаться некоторое количество аустенита. Если образец продолжать держать при 650 °С, то перлитные зерна будут расти пока не закончится весь аустенит.


































