Классификация железоуглеродистых сплавов
Классификация железоуглеродистых сплавов в зависимости от концентрации углерода в сплаве:
- C<0,025%. Техническое железо. При комнатной температуре будет состоять только из феррита;
- 0,025<C<2,14. Стали:
-
- 0,025<C<0,8. Доэвтектоидные стали. Состав: феррит + перлит (или третичный цементит);
- C=0,8. Эвтектоидная сталь. «Чистый» перлит;
- 0,8<C<2,14. Заэвтектоидная сталь. Состав: вторичный цементит + перлит;
- 2,14<C<6,67. Чугуны:
-
- 2,14<C<4,3. Доэвтектический чугун. Состав: ледебурит + перлит + вторичный цементит;
- C=4,3. Эвтектический чугун. «Чистый» ледебурит;
- 4,3<C<6,67. Заэвтектический чугун. Состав: ледебурит + цементит.
Техническое железо выделяет то, что оно состоит исключительно из феррита. Который и определяет его свойства: мягкость, чрезвычайную пластичность и т.д.
Чугуны же выделяет наличие ледебурита, придающего им хрупкость. Поэтому чугуны не могут подвергаться ковке. Зато обладают лучшими литейными свойствами (чем стали), обусловленными наличием легкоплавкого ледебурита.
Строение и свойства
При повышении температуры аустенитные стали превращаются в жидкий раствор с определённым процентным отношением железа и углерода. Если температура раствора превышает линию так называемого ликвидуса (это около 1700 °C),образовавшийся расплав становится статически неустойчивым. Его состояние оценивают по двум составляющим:фазовой и структурной.
Для первой составляющей основным показателем является фаза состояния полученной смеси. Она определяет состояние металла по следующим показателям:
- раствора углерода в железе;
- количество различных образований (непосредственно феррит, в том числе высокотемпературный, аустенит, цементит).

Структурная составляющая часть образца определяется как гомогенная или квазигомогенная форма. Общая структура образовавшегося феррита составляет равноосные кристаллы. В трёхмерном пространстве решётка ферритной фазы представляет объёмно-центрированный куба. Эти кристаллы определяют твёрдость феррита и способность углерода в нём растворяться. Опыт показывает, что при температуре равной 727 градусов в феррите растворяется только 0,02% углерода.
Кроме этого к основным свойствам феррита относятся:
- обладает сильными ферромагнитными свойствами (до температуры 770 °С — точка Кюри);
- является теплопроводным элементом;
- хорошим проводником электрического тока;
- обладает повышенной пластичностью.
К основным недостаткам относятся невысокая прочность и недостаточная твёрдость. Последний показатель зависит от величины образованного зерна и находится в интервале от 65 до 130 НВ.
В зависимости от этапа проходящих превращений ферритная фаза находится в следующих состояниях:
- как основа кристаллической решётки образовавшегося сплава;
- второе или избыточное состояние (располагается по границам так называемых перлитных образований);
- элемент феррито-графитного эвтектоида.
Каждое состояние требует точного определения и выявления возникающих преобразований. От них во многом зависят характеристики конечного продукта.Полное отсутствие ферритного образования или незначительное его содержание проявляется с образованием горячих трещин. Завышенное содержание этого показателя снижает пластичность, ударную вязкость и антикоррозийную стойкость.
Классификация металлов по температуре плавления
Разные металлы могут переходить в жидкое состояние при разной температуре. Вследствие этого выделяют определённую классификацию. Их делят следующим образом:
- Легкоплавкие — те элементы, которые могут становиться жидкими уже при температуре ниже 600 градусов. К ним относят цинк, олово, свинец и пр. Их можно расплавить даже в домашних условиях — просто нужно разогреть при помощи плиты или паяльника. Такие виды нашли применение в технике и электронике. Они используются для соединения элементов из металла и движения электрического тока. Олово плавится при 232 градусах, а цинк — при 419 градусах.
- Среднеплавкие — элементы, которые начинают расплавляться при температуре от шестисот до тысячи шестисот градусов. Эти элементы используют по большей части для строительных элементов и металлоконструкций, то есть при создании арматур, плит и строительных блоков. В эту группу входят: железо, медь, алюминий. Температура плавления алюминия сравнительно низка и составляет 660 градусов. А вот железо начинает переходить в жидкое состояние лишь при температуре 1539 градусов. Это один из самых распространенных металлов, используемых в промышленности, особенно в автомобильной. Однако железо подвержено коррозии, то есть ржавчине, поэтому ему требуется специальная поверхностная обработка. Его необходимо покрывать краской или олифой, и не допускать попадание влаги.
- Тугоплавкие — это такие материалы, которые расплавляются и становятся жидкими при температуре выше 1600 градусов. В эту группу относят вольфрам, титан, платину, хром и т. п. Они используются в ядерной промышленности и для некоторых машинных деталей. Они могут применяться для расплавки других металлов, изготовления высоковольтных проводов или проволоки. Платину можно расплавить при 1769 градусах, а вольфрам — при 3420 °C.
Единственный элемент, который при обычных условиях находится в жидком состоянии — это ртуть. Температура его плавления составляет минус 39 градусов и его пары являются ядовитыми, поэтому его используют только в лабораториях и закрытых ёмкостях.
Фазы в системе «железо-углерод»
В системе железо – углерод существуют следующие фазы: жидкая фаза, феррит, аустенит, цементит, графит.
Жидкая фаза
Жидкая фаза. В жидком состоянии железо хорошо растворяет углерод в любых пропорциях с образованием однородной жидкой фазы.
Феррит
Феррит (Ф, α)- твердый раствор внедрения углерода в α-железе (от латинского слова ferrum – железо). Различают низкотемпературный феррит с предельной растворимостью углерода 0,02 % при температуре 727° С (точка P) и высокотемпературный δ-феррит (в интервале температур 1392…1539° С) с предельной растворимостью углерода 0,1 % при температуре 1499° С (точка J).
Свойства феррита близки к свойствам железа. Он мягок (твердость – 80 — 130 НВ, временное сопротивление – σв=300 МПа) и пластичен (относительное удлинение — δ=50 %), магнитен до 768° С.
Под микроскопом феррит выглядит как светлые полиэдрические зерна. В сталях может существовать в виде сетки (разной толщины, в зависимости от содержания углерода), зерен (малоуглеродистые стали), пластин или игл (видманштетт).
Аустенит в сталях
Аустенит (А, γ) – твердый раствор внедрения углерода в γ–железо (по имени английского ученого Р. Аустена). Углерод занимает место в центре гранецентрированной кубической ячейки. Предельная растворимость углерода в γ -железе 2,14 % при температуре 1147° С (точка Е). Аустенит имеет твердость 180 НВ, пластичен (относительное удлинение – δ=40…50 %), парамагнитен. При растворении в аустените других элементов могут изменяться свойства и температурные границы существования. Под микроскопом выглядит как светлые полиэдрические зерна с двойниками.
Цементит – формы существования
В железоуглеродистых сплавах присутствуют фазы: цементит первичный, цементит вторичный, цементит третичный. Химические и физические свойства этих фаз одинаковы. Влияние на механические свойства сплавов оказывает различие в размерах, количестве и расположении этих выделений. Цементит первичный выделяется из жидкой фазы в виде крупных пластинчатых кристаллов. Цементит вторичный выделяется из аустенита и располагается в виде сетки вокруг зерен аустенита (при охлаждении – вокруг зерен перлита). Цементит третичный выделяется из феррита и в виде мелких включений располагается у границ ферритных зерен.
Поскольку углерод в сплавах с железом встречается в виде цементита и графита, существуют две диаграммы состояния, описывающие условия равновесия фаз в системах железо — цементит и железо — графит. Первая диаграмма (Fе — Fе3С) называется цементитной (метастабильная), вторая (Fе — С) — графитной (стабильная). Оба варианта диаграммы приводятся вместе в одной системе координат: температура — содержание углерода. Диаграмма состояния системы железо — углерод построена по результатам многочисленных исследований, проведенных учеными ряда стран. Особое место среди них занимают работы Д.К. Чернова
Он открыл существование критических точек в стали, определил их зависимость от содержания углерода, заложил основы для построения диаграммы состояния железоуглеродистых сплавов в ее нижней, наиболее важной части
Буквенное обозначение узловых точек в диаграмме является общепринятым как в России, так и за рубежом.
Диаграмма состояния железо-углерод
Имеющиеся во всех областях диаграммы фазы видны на рисунке. Значение всех линий указано в таблице.
Ликвидус по всей диаграмме проходит по линиям АВ, ВС, СD; солидус — по линиям АН, НJ, JЕ, ЕСF. Сплавы железа с углеродом обычно делят на стали и чугуны. Условной границей для такого деления является 2,14 % С (точка E). Сплавы, содержащие углерода менее 2,14 %, относятся к сталям, более 2,14 % — к чугунам.
Температуры, при которых происходят фазовые и структурные превращения в сплавах системы железо – цементит, т.е. критические точки, имеют условные обозначения. Обозначаются буквой А. В зависимости от того, при нагреве или при охлаждении определяется критическая точка, к букве А добавляется индекс с (от слова chauffage – нагрев) при нагреве и индекс r (от слова refroidissement – охлаждение) при охлаждении с оставлением цифры, характеризующей данное превращение.
Таким образом, например, нагрев доэвтектоидной стали выше соответствующей точки на линии GS обозначается как нагрев выше точки АС3. При охлаждении же этой стали первое превращение должно быть обозначено как Аr3, второе (на линии РSК) — как Аr1.
Физика 8 класс. Плавление и кристаллизация
Физика 8 класс Конспект ПлавлениеПлавление и кристаллизация. Удельная теплота плавления.
Задачи на тему Тепловые явления
Переход вещества из твердого состояния в жидкое называется плавлением.
Плавление кристаллических тел происходит только при определенной температуре.
Температуру, при которой вещество плавится, называют температурой плавления вещества.
Чтобы провести процесс плавления, сначала надо нагреть твердое тело до температуры плавления.
Если тело нагреть до температуры плавления и убрать нагреватель (перестать подводить тепло к телу) — то плавления не происходит.
Чтобы осуществить плавление тела, надо выполнить два условия: 1. нагреть тело до температуры плавления 2. продолжить передачу теплоты
Температура плавления — важная тепловая характеристика вещества. У разных веществ температура плавления различна.

Плавление металла
Переход вещества из жидкого состояния в твердое называют отвердеванием или кристаллизацией.
Чтобы началась кристаллизация расплавленного (жидкого) тела, оно должно остыть до определенной температуры.
Температура, при которой вещество отвердевает (кристаллизуется), называют температурой отвердевания или кристаллизации.
График плавления и отвердевания кристаллических тел.
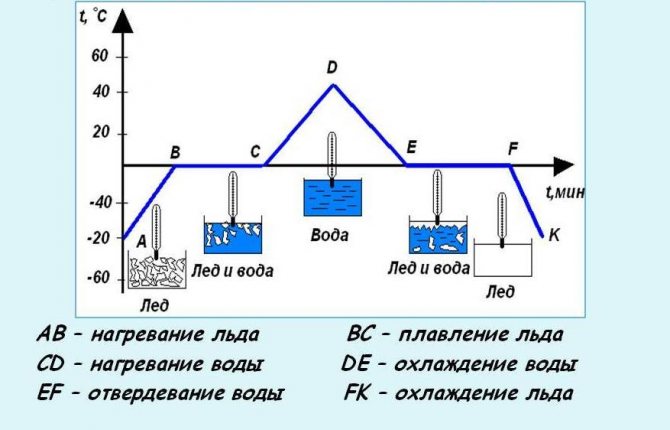
График плавления и отвердевания
Опыт показывает, что вещества отвердевают при той же температуре, при которой плавятся.
Чтобы осуществить процесс отвердевания нужно выполнить два условия: 1. охладить жидкость до температуры отвердевания (плавления) 2. продолжать отводить тепло до тех пор, пока вся жидкость не отвердеет.
Физическая величина, показывающая, какое количество теплоты необходимо сообщить кристаллическому телу массой 1 кг, чтобы при температуре плавления полностью перевести его в жидкое состояние, называется удельной теплотой плавления.
Удельную теплоту плавления обозначают буквой λ, измеряют в Дж/кг.
Чтобы вычислить количество теплоты Q, необходимое для плавления кристаллического тела массой m, взятого при его температуре плавления и нормальном атмосферном давлении,
нужно удельную теплоту плавления λ умножить на массу тела:
где Q– количество теплоты, m– масса тела.
Температура плавления и кристаллизации для данного вещества при неизменном внешнем давлении равны.

Кристаллизация
Количество теплоты, выделяющееся при кристаллизации вещества, при неизменном внешнем давлении равно количеству теплоты, полученному этим веществом при плавлении.
Задачи
Испарение и конденсация
Конспект составлен на основании теоретического материала учебника «Физика 8 класс» А.В. Перышкин, «Физика 8 класс»А.В.Грачев.
Скачать конспект:
teoriya_8_plavleniekristallizacziya
Физика 8 класс. Количество теплоты. Удельная теплоемкость. Топливо.
Физика 8 класс. Кипение. Конденсация.
Физика 8 класс. Испарение. Насыщенный пар. Влажность воздуха.
Физика 8 класс. Тепловые явления. Внутренняя энергия.
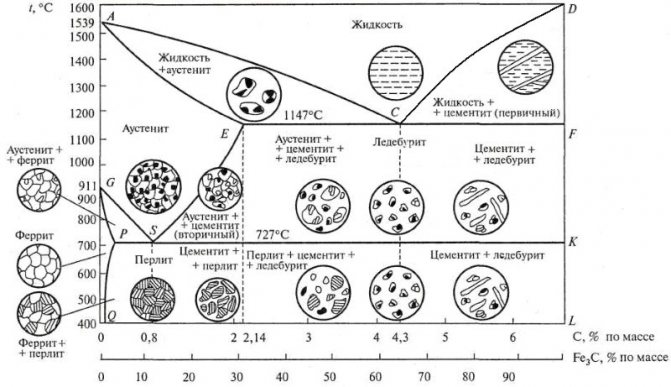
Некоторые элементы диаграммы железо-углерод
Выделим несколько границ на диаграмме железо-углерод:
- линия ACD. Линия ликвидус. При охлаждении сплавов ниже нее начинается их кристаллизация;
- линия AECF. Линия солидус. При охлаждении сплавов ниже нее весь сплав переходит в твердое состояние;
- линия ECF. Иногда называется линией ледебуритного превращения. При охлаждении сплавов с содержанием углерода выше 2,14% ниже нее жидкая фаза превращается в ледебурит;
- линия PSK. Линия перлитного превращения. При охлаждении сплавов ниже нее аустенит превращается в перлит.
Отметим несколько важных точек на диаграмме:
- точка E. Точка максимального насыщения аустенита углеродом – 2,14%, при температуре 1147°С;
- точка P. Точка максимального насыщения феррита углеродом – 0,025%, при температуре 727°С;
- точка S. Точка «0,8% С-727°С» превращения аустенита с концентрацией углерода 0,8% в перлит (эвтектоид) той же средней концентрации;
- точка C. Точка «2,14 % С-1147°С» превращения жидкости с концентрацией углерода 2,14% в ледебурит (эвтектику) той же средней концентрации.
Часто значения температур, при которых происходят структурные изменения конкретного сплава обозначают буквами A:
- A1 – линия PSK;
- A2 – линия MO – точка Кюри, в которой происходит изменение магнитных свойств сплавов;
- A3 – температуры, соответствующие линии GS;
- Acm – температуры, соответствующие линии SE.
Поскольку температуры фазовых переходов при нагреве и охлаждении слегка отличаются, то часто вводят дополнительные буквенные обозначения:
- с – для температур фазовых переходов при нагреве;
- r – при охлаждении,
например, Ac1 или Ar1.
Первичный, вторичный и третичный цементит
По способу и области образования он подразделяется на три основных вида:
- первичный;
- вторичный;
- третичный.
Образование первичного цементита наблюдается в процессе кристаллизации заэвтектического чугуна. В этот момент образуются кристаллы вытянутой формы. Они образовывают первичный карбид. Первичное образование может проявляться в доэвтектическом чугуне в составе ледебурита в процессе кристаллизации расплава. Проведенные исследования показали, что такая смесь железа и углерода присутствует не только в белом чугуне. Она может проявиться в сером чугуне после завершения операции так называемой графитизации.
Процесс образования вторичного вида наблюдается в основном при охлаждении аустенита. Это явление наблюдается при снижении температуры ниже 1147 °С. При такой температуре происходит снижение концентрации углерода в аустените. Освободившиеся атомы углерода вступают в новые связи, и образуется цементит, который называется вторичным. При дальнейшем снижении температуры до эвтектоидной продолжается его формирование. Даже при комнатной температуре он встречается в составе перлита. В этих условиях его можно обнаружить в заэвтектоидной стали. Он образовывается на границах зернистой структуры.
Процесс охлаждения феррита формирует так называемый третичный цементит. Данный вид достаточно сложно зафиксировать, и проводит дальнейшее наблюдение за его образованием. Эта проблема связана с появлением третичного цементита в небольших количествах. Исследования образования данной фракции показали, что он приобретает несколько форм: пластинки, прожилки или в форме иголок. Все эти элементы формируются в зёрнах феррита. Третичное образование достаточно сложно получить, потому что при повышении процентного содержания углерода третичный цементит соединяется с перлитом. При повышении скорости охлаждения содержание углерода сохраняется в растворе металла и образование третичной фракции прекращается. Явным признаком образования является результат постепенного старения феррита. В этом случае в содержании феррита изменяется концентрация углерода.
Из приведенного выше описания можно сделать следующие выводы:
- первичная фракция образовывается в результате кристаллизации расплава;
- вторичный – в результате последовательного охлаждения аустенита;
- третичный – после охлаждения феррита.
В различных марках стали и чугуна цементит первичный обладает высокой вариативностью формы. Это могут быть пластины правильной формы полоски или образования в форме иголок. При проведении операции отжига он может принимать форму округлых образований. Как результат трансформируется в зернистый перлит.
Эвтектоидный перлит
Содержание углерода, при котором аустенит имеет минимальную температуру, называется эвтектоидным содержанием (0,77 % углерода по массе для случая метастабильной диаграммы состояния). Смесь ферритной и цементитной фаз при этом составе углерода, которая образуется при медленном охлаждении имеет характерную пластинчатую структуру, которую называют перлитом. Перлит представляет собой совокупность чередующихся пластин феррита и цементита. Эти пластины после выдержки при температуре близкой к А1 огрубляются («сфероидизируются») в цементитные частицы, распределенные в ферритной матрице.
Некоторые элементы диаграммы железо-углерод
Выделим несколько границ на диаграмме железо-углерод:
- линия ACD. Линия ликвидус . При охлаждении сплавов ниже нее начинается их кристаллизация;
- линия AECF. Линия солидус . При охлаждении сплавов ниже нее весь сплав переходит в твердое состояние;
- линия ECF. Иногда называется линией ледебуритного превращения. При охлаждении сплавов с содержанием углерода выше 2,14% ниже нее жидкая фаза превращается в ледебурит;
- линия PSK. Линия перлитного превращения . При охлаждении сплавов ниже нее аустенит превращается в перлит.
Отметим несколько важных точек на диаграмме:
- точка E. Точка максимального насыщения аустенита углеродом – 2,14%, при температуре 1147°С;
- точка P. Точка максимального насыщения феррита углеродом – 0,025%, при температуре 727°С;
- точка S. Точка «0,8% С-727°С» превращения аустенита с концентрацией углерода 0,8% в перлит (эвтектоид) той же средней концентрации;
- точка C. Точка «2,14 % С-1147°С» превращения жидкости с концентрацией углерода 2,14% в ледебурит (эвтектику) той же средней концентрации.
Часто значения температур, при которых происходят структурные изменения конкретного сплава обозначают буквами A:
- A1 – линия PSK;
- A2 – линия MO – точка Кюри, в которой происходит изменение магнитных свойств сплавов;
- A3 – температуры, соответствующие линии GS;
- Acm – температуры, соответствующие линии SE.
Поскольку температуры фазовых переходов при нагреве и охлаждении слегка отличаются, то часто вводят дополнительные буквенные обозначения:
- с – для температур фазовых переходов при нагреве;
- r – при охлаждении,
например, Ac1 или Ar1.
Производство
Изготовлением, подготовкой и выпуском доэвтектоидного металла в России занимаются многие предприятия. Например, Уральский завод цветных металлов (УЗЦМ) производит сразу несколько марок стали такого типа, предлагая потребителю разные наборы технико-физических свойств. Уральский сталелитейный завод выпускает ферритовые стали, в состав которых входят высококачественные легированные компоненты. Кроме того, в ассортименте доступны особые модификации сплавов, в том числе жаропрочные, высокохромистые и нержавеющие металлы.
Среди крупнейших производителей можно выделить и предприятие «Металлоинвест». На мощностях этой компании выпускаются конструкционные стали с доэвтектоидной структурой, рассчитанные на использование в строительстве. На данный момент сталелитейный завод предприятия работает по новым стандартам, позволяющим улучшать и слабое место ферритовых сплавов – прочностный показатель. В частности, технологи компании работают над повышением коэффициента интенсивности напряжения, над оптимизацией ударной вязкости и показателями сопротивления усталости материала. Это позволяет предлагать сплавы практически универсального назначения.
Фазы в системе «железо-углерод»
В системе железо – углерод существуют следующие фазы: жидкая фаза, феррит, аустенит, цементит, графит.
Жидкая фаза
Жидкая фаза. В жидком состоянии железо хорошо растворяет углерод в любых пропорциях с образованием однородной жидкой фазы.
Феррит
Феррит (Ф, α)- твердый раствор внедрения углерода в α-железе (от латинского слова ferrum – железо). Различают низкотемпературный феррит с предельной растворимостью углерода 0,02 % при температуре 727° С (точка P) и высокотемпературный δ-феррит (в интервале температур 1392…1539° С) с предельной растворимостью углерода 0,1 % при температуре 1499° С (точка J).
Свойства феррита близки к свойствам железа. Он мягок (твердость – 80 — 130 НВ, временное сопротивление – σв=300 МПа) и пластичен (относительное удлинение — δ=50 %), магнитен до 768° С.
Под микроскопом феррит выглядит как светлые полиэдрические зерна. В сталях может существовать в виде сетки (разной толщины, в зависимости от содержания углерода), зерен (малоуглеродистые стали), пластин или игл (видманштетт).
Аустенит в сталях
Аустенит (А, γ) – твердый раствор внедрения углерода в γ–железо (по имени английского ученого Р. Аустена). Углерод занимает место в центре гранецентрированной кубической ячейки. Предельная растворимость углерода в γ -железе 2,14 % при температуре 1147° С (точка Е). Аустенит имеет твердость 180 НВ, пластичен (относительное удлинение – δ=40…50 %), парамагнитен. При растворении в аустените других элементов могут изменяться свойства и температурные границы существования. Под микроскопом выглядит как светлые полиэдрические зерна с двойниками.
Цементит – формы существования
В железоуглеродистых сплавах присутствуют фазы: цементит первичный, цементит вторичный, цементит третичный. Химические и физические свойства этих фаз одинаковы. Влияние на механические свойства сплавов оказывает различие в размерах, количестве и расположении этих выделений. Цементит первичный выделяется из жидкой фазы в виде крупных пластинчатых кристаллов. Цементит вторичный выделяется из аустенита и располагается в виде сетки вокруг зерен аустенита (при охлаждении – вокруг зерен перлита). Цементит третичный выделяется из феррита и в виде мелких включений располагается у границ ферритных зерен.
Поскольку углерод в сплавах с железом встречается в виде цементита и графита, существуют две диаграммы состояния, описывающие условия равновесия фаз в системах железо — цементит и железо — графит. Первая диаграмма (Fе — Fе3С) называется цементитной (метастабильная), вторая (Fе — С) — графитной (стабильная). Оба варианта диаграммы приводятся вместе в одной системе координат: температура — содержание углерода. Диаграмма состояния системы железо — углерод построена по результатам многочисленных исследований, проведенных учеными ряда стран. Особое место среди них занимают работы Д.К. Чернова
Он открыл существование критических точек в стали, определил их зависимость от содержания углерода, заложил основы для построения диаграммы состояния железоуглеродистых сплавов в ее нижней, наиболее важной части
Буквенное обозначение узловых точек в диаграмме является общепринятым как в России, так и за рубежом.
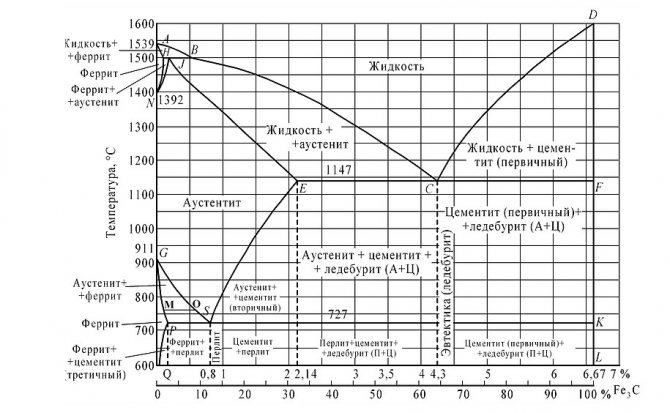
Диаграмма состояния железо-углерод
Имеющиеся во всех областях диаграммы фазы видны на рисунке. Значение всех линий указано в таблице.
Ликвидус по всей диаграмме проходит по линиям АВ, ВС, СD; солидус — по линиям АН, НJ, JЕ, ЕСF. Сплавы железа с углеродом обычно делят на стали и чугуны. Условной границей для такого деления является 2,14 % С (точка E). Сплавы, содержащие углерода менее 2,14 %, относятся к сталям, более 2,14 % — к чугунам.
Температуры, при которых происходят фазовые и структурные превращения в сплавах системы железо – цементит, т.е. критические точки, имеют условные обозначения. Обозначаются буквой А. В зависимости от того, при нагреве или при охлаждении определяется критическая точка, к букве А добавляется индекс с (от слова chauffage – нагрев) при нагреве и индекс r (от слова refroidissement – охлаждение) при охлаждении с оставлением цифры, характеризующей данное превращение.
Таким образом, например, нагрев доэвтектоидной стали выше соответствующей точки на линии GS обозначается как нагрев выше точки АС3. При охлаждении же этой стали первое превращение должно быть обозначено как Аr3, второе (на линии РSК) — как Аr1.
Полиморфные превращения
Более подробно о каждой фазе чуть ниже в статье. А если кратко, то осуществление главных превращений происходит при особых температурах.
Состояние железа обозначают как α-феррум (при температуре менее 911° С) . Кристаллическая решетка – объемный гранецентрированный куб. Или ОЦК. Дистанция между атомами такой решетки достаточно высокая.
Железо приобретает модификацию гамма, то есть обозначается как γ-феррум (911-1392° С) . Кристаллическая решетка — гранецентрированный куб (ГЦК). В этой решетке дистанция между атомами ниже, чем в ОЦК.
При переходе α-феррума в γ-феррум объем вещества становится меньшим. Причиной тому является кристаллическая решетка – ее вид. Потому что решетка ГЦК имеет более упорядоченное состояние атомов, чем ОЦК.
Если переход осуществляется в обратном направлении — из γ-феррума в α-феррум, то объем сплава увеличивается.
Когда температура достигает значения 1392° С (но менее температуры плавления железа 1539° С), то α-феррум превращается в δ-феррум, но это не является ее новой формой, а лишь разновидностью. К тому же δ-феррум является неустойчивой структурой.
Фазы диаграммы железо-углерод
В системе железо — углерод существуют следующие фазы: жидкая фаза, феррит, аустенит, цементит, графит.
Жидкая фаза. В жидком состоянии железо хорошо растворяет углерод в любых пропорциях с образованием однородной жидкой фазы.
Феррит — твёрдый раствор внедрения углерода в α-железе с объёмно-центрированной кубической решёткой.
Феррит имеет переменную, зависящую от температуры предельную растворимость углерода: минимальную — 0,006 % при комнатной температуре (точка Q), максимальную — 0,02 % при температуре 700 °C (точка P). Атомы углерода располагаются в центре грани или (что кристаллогеометрические эквивалентно) на середине рёбер куба, а также в дефектах решетки.
При температуре выше 1392 °C существует высокотемпературный феррит с предельной растворимостью углерода около 0,1 % при температуре около 1500 °C (точка H).
Свойства феррита близки к свойствам чистого железа. Он мягок (твёрдость по Бринеллю — 130 НВ) и пластичен, ферромагнитен (при отсутствии углерода) до точки Кюри — 770 °C.
Аустенит (γ) — твёрдый раствор внедрения углерода в γ-железе с гранецентрированной кубической решёткой.
Атомы углерода занимают место в центре гранецентрированной кубической ячейки. Предельная растворимость углерода в аустените — 2,14 % при температуре 1147 °C (точка Е). Аустенит имеет твёрдость 200—250 НВ, пластичен, парамагнитен. При растворении других элементов в аустените или в феррите изменяются свойства и температурные границы их существования .
Цементит (Fe3C) — химическое соединение железа с углеродом (карбид железа), со сложной ромбической решёткой, содержит 6,67 % углерода. Он твёрдый (свыше 1000 HВ), и очень хрупкий. Цементит — метастабильная фаза и при длительном нагреве самопроизвольно разлагается с выделением графита.
В железоуглеродистых сплавах цементит как фаза может выделяться при различных условиях:
- цементит первичный (выделяется из жидкости),
- цементит вторичный (выделяется из аустенита),
- цементит третичный (из феррита),
- цементит эвтектический и
- эвтектоидный цементит.
Цементит первичный выделяется из жидкой фазы в виде крупных пластинчатых кристаллов. Цементит вторичный выделяется из аустенита и располагается в виде сетки вокруг зёрен аустенита (после эвтектоидного превращения они станут зёрнами перлита). Цементит третичный выделяется из феррита и в виде мелких включений располагается у границ ферритных зёрен .
Эвтектический цементит наблюдается лишь в белых чугунах. Эвтектоидный цементит имеет пластинчатую форму и является составной частью перлита. Цементит может при специальном сфероидизируюшем отжиге или закалке с высоким отпуском выделяться в виде мелких сфер. Влияние на механические свойства сплавов оказывает форма, размер, количество и расположение включений цементита, что позволяет на практике для каждого конкретного применения сплава добиваться оптимального сочетания твёрдости, прочности, стойкости к хрупкому разрушению и т. п.
Графит — фаза состоящая только из углерода со слоистой гексагональной решёткой. Плотность графита (2,3 г/см3) намного меньше плотности всех остальных фаз (около 7,5—7,8 г/см3) и это затрудняет и замедляет его образование, что и приводит к выделению цементита при более быстром охлаждении. Образование графита уменьшает усадку при кристаллизации, графит выполняет роль смазки при трении, уменьшая износ, способствует рассеянию энергии вибраций.
Графит имеет форму крупных крабовидных (изогнутых пластинчатых) включений (обычный серый чугун) или сфер (высокопрочный чугун).
Графит обязательно присутствует в серых чугунах и их разновидности — высокопрочных чугунах. Графит присутствует также и в некоторых марках стали — в так называемых графитизированных сталях.
Компоненты в системе железо углерод
Аустенит
Атомы размещается в гранецентрированной ячейке. Твердость аустенита имеет твердость 200 … 250 единиц по Бринеллю. Кроме того у него хорошая пластичность и он отличается парамагнитностью.
Железо
Железо – это материал, относящийся к металлам. Его натуральный цвет – серебристо-серый. В чистом виде он очень пластичен. Его удельный вес составляет 7,86 г/куб. см. Температура плавления составляет 1539 °C. На практике чаще всего применяют техническое железо, в составе которого присутствуют следующие примеси – марганец, кремний и многие другие. Массовая доля примесей не превышает 0,1%.

Железо
У железа есть такое свойство как полиформизм. То есть, при одном и том же химическом составе, это вещество может иметь разную структуру кристаллической решетки и соответственно разные свойства. Модификации железа называют соответственно – Б, Г, Д. Все эти модификации существуют при разных условиях. Например, тип Б, может существовать только при температуре 911 °С. Тип Г может существовать в диапазоне от 911 до 1392 °С. Тип Д существует в диапазоне от 1392 до 1539 °С.
Каждый из типов обладает своей формой кристаллической решеткой, например, у типа Б решетка представляет собой куб, решетка типа Г имеет гранецентрированную кубическую форму. Решетка типа Д, имеет форму объемно центрированного куба.
Еще одно свойство состоит в том, что при температуре ниже 768 железо ферримагнитно, а при ее повышении это свойство теряется.
Точки полиморфной и магнитной трансформации называют критическими. На таблице они обозначены следующим образом – А2, А3, А4. Цифровые индексы показывают тип трансформации. Для более полного различия превращения железа из одного вида в другой к обозначению добавляют индексы с и r. Первый говорит о нагреве, второй об охлаждении.

Полиморфные модификации железа
При высоких параметрах пластичности, железо не обладает высокой твердостью, по шкале Бринелля она равна 80 единиц.
Железо имеет возможность образовывать твердые растворы. Их можно разделить на две группы – раствор замещения и внедрения. Первые состоят их железа и других металлов, вторые из железа и углерода, водорода и азота.
Углерод
Другой компонент системы – углерод. Это – неметалл и он обладает тремя модификациями в виде алмаза, графита и угля. Он плавится при 3500 °С.
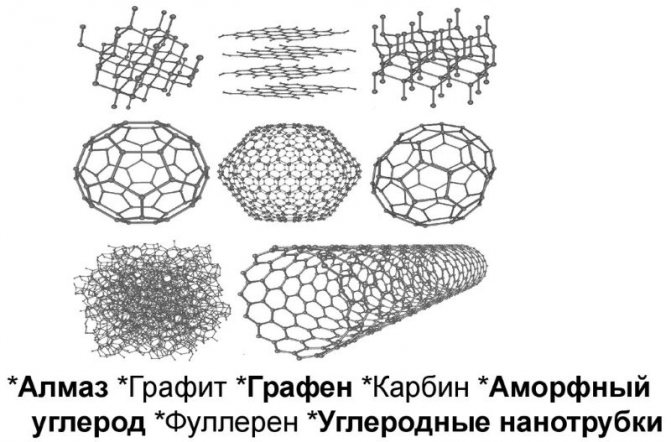
Аллотропные модификации углерода
В сплаве железа, этот элемент находится в виде твердого раствора, его называют цементит или в виде графита. В таком виде он присутствует в сером чугуне. Графит, не отличается ни пластичностью, ни прочностью.
Цементит
Доля углерода составляет 6,67%. Он обладает высокой твердостью – 800 НВ, но при этом у него отсутствует пластичность. Полиморфными свойствами не обладает.
Он обладает следующим свойством – при формировании раствора замещения, углерод может быть заменен на атомы других веществ, например, на хром или никель. Такой раствор получил название легированного раствора.

Цементит
Он не обладает устойчивостью, при наличии некоторых условий он может разлагаться, при этом происходит трансформация углерода в графит. Это свойство нашло применение при образовании чугунов.
Кстати, в жидком состоянии, железо может растворять в себе примеси, при этом образуя, однородная масса.
Феррит
Так называют твердый раствор, при котором происходит внедрение углерода в железо.
Он растворяется с определенной переменностью, при нормальной (комнатной) температуре объем углерода лежит в пределах 0,006%, при 727 °С, то концентрация углерода составит 0,02%. По достижении 1392 °С образуется феррит.

Феррит
Содержание углерода составит 0,1%. Его атомы размещаются в дефектных узлах решетки.
Феррит по своим параметрам близок к железу.
Выводы
Достичь абсолютного равновесия, как физического, так и химического, невозможно, кроме как в специальных лабораторных условиях.
На практике равновесие может быть приближено к абсолютному, но при определенных условиях: достаточно медленного повышения или понижения температуры сплава, который будет длительно выдерживаться по времени.
Источники
- https://FB.ru/article/340918/diagramma-jeleza-ugleroda-diagramma-sostoyaniya-sistemyi-jelezo-uglerod
- https://PokVorota3.ru/prokat/zhelezo-uglerod-2.html
- https://intehstroy-spb.ru/spravochnik/diagramma-sostoyaniya-zhelezo-uglerod-2.html
- https://NiceSpb.ru/materialy/diagramma-zhelezo.html
- https://pressadv.ru/stali/zhelezo-uglerod.html
- https://wiki2.org/ru/%D0%94%D0%B8%D0%B0%D0%B3%D1%80%D0%B0%D0%BC%D0%BC%D0%B0_%D1%81%D0%BE%D1%81%D1%82%D0%BE%D1%8F%D0%BD%D0%B8%D1%8F_%D1%81%D0%BF%D0%BB%D0%B0%D0%B2%D0%BE%D0%B2_%D0%B6%D0%B5%D0%BB%D0%B5%D0%B7%D0%BE-%D1%83%D0%B3%D0%BB%D0%B5%D1%80%D0%BE%D0%B4
- https://generator98.ru/raboty-so-stalyu/tablica-zhelezo-uglerod.html
































