Карборунд: что это такое?

На самом деле, камень, созданный по велению небес, имеет природное происхождение, но встречается там в очень мизерных количествах. Карборунд, на языке ученых называемый карбидом кремния, имеет вид бесцветных, переливчатых кристаллов с алмазным блеском.
Итак, карборунд относится ко классу полупроводникового бинарного химического соединения, состоит из кремния и углерода, обозначается химической формулой SiC.
Этот материал очень тугоплавок и прочен. По сравнению с муассанитом, даже сам бриллиант, тихонечко отдыхает в сторонке. По прочности карборунд уступает пальму первенства лишь алмазу и боразону.
Природное происхождение карборунда
Уникальное, на диво прекрасное слияние кремния и углерода породило появление на свет блистательного минерала с легким оттеночным алмазным сиянием, это зрелище Богов, которое берет за душу своей непреклонной хрупкостью, удивительной нежностью и ангельской глубиной красоты.
В природе горстки мелких камушков – карбида кремния, распространены в очень малых количествах, поэтому крупные залежи найти не удалось. А почему не удалось – загадка века, над которой ломают головы все ученые.
Искусственное происхождение карборунда
Ювелирное искусство во все времена вызывало интерес у всех слоев населения. Чистый, радужный, наивный блеск драгоценностей будоражил сердце, заставляя его колотиться в сто крат сильнее, люди, как вороны, тянулись к тому, что сверкает и блестит.
И вот в 20 веке, на счастье народа, появился самый блестящий камень на планете – муассанит, от природы сам по себе очень красив, но какова красота усовершенствованного камня – просто ошеломительна!
Искусственный муассанит – это уникальное в своем роде сочетание истинного искусства и науки. В настоящее время на обработке карборунда специализируется всего одна-единственная компания в мире под названием Charles&Colvard.
Весь процесс происходит на новейшем высокотехнологичном оборудовании, специалисты внимательно следят за стадией роста камня, поэтому в структуре данного минерала нет ни единого изъяна! В результате в свет вышла новинка, произведенная по запатентованной технологии, эта новинка по красоте бьет все рекорды, это минерал наивысочайшего качества, который запечатлен в сердцах миллионов людей надолго.
Легендарный муассанит с его глубокой игрой света на гранях – один из самых благородных минералов в ювелирной коллекции, муассанит переливается самыми чистыми оттенками на свете, благодаря этому достигается уникальная внутренняя его красота, несравнимая с красотой любого другого камня на свете.
Глубокие ценители утонченности и эстетической красоты – ювелиры и коллекционеры, говорят о минерале, как о «венце творения»! Этот камень настолько хрупок, чист и священен, насколько это только можно! Это камень на миллион!
Предпосылки для производства кристаллов SiC
Для начала производства кристаллов SiC (которое экспертами называется «выращивание») необходимо иметь соответствующие компоненты и оборудование. Сюда входит непосредственно оборудование для выращивания кристаллов, технология выращивания, различные носители, исходный материал SiC и затравочные кристаллы. SiC выступает в качестве сырья в процессе роста и постоянно подпитывает растущий кристалл.
Исходный материал обычно имеет форму порошка, он изготавливается при подготовке производства. Этот высокотемпературный и строго контролируемый процесс объединяет базовые материалы — очень чистый кремний и углерод. Прецизионный контроль гарантирует, что используемый базовый материал обладает конкретной, заданной чистотой, стехиометрией, размером и распределением зерен и другими заранее определенными параметрами.
Затравочный кристалл представляет собой монокристаллическую круглую SiC-пластину, он инициирует (и в значительной степени контролирует) рост крупного монокристалла, отсюда и термин «затравочный». Подобно семенам растения, «затравка» несет «генетическую информацию», которая передается растущему кристаллу. Структурное совершенство затравочного материала во многом определяет плотность дефектов в окончательной структуре. Многоступенчатый процесс селекции, непрерывно используемый компанией Rohm, гарантирует, что «затравка» будет производиться только из лучшего материала, имеющего оптимальное качество. Этот постоянный внутренний отбор действует как процесс дистилляции, непрерывно совершенствующий качество «зародышей» и конечного продукта.
Изотопы и их применение
Основная статья: Изотопы кремния
Кремний состоит из стабильных изотопов 28Si (92,23 %), 29Si (4,67 %) и 30Si (3,10 %). Остальные изотопы являются радиоактивными.
Ядро 29Si (как и протон) имеет ядерный спин I = 1/2 и все шире используется в спектроскопии ЯМР. 31Si, образующийся при действии нейтронов на 30Si, имеет период полураспада равный 2,62 ч. Его можно определить по характеристическому β-излучению, и он очень удобен для количественного определения кремния методом нейтронно-активационного анализа. Радиоактивный нуклид 32Si имеет самый большой период полураспада (~170 лет) и является мягким (низкоэнергетическим) β-излучателем.
Применение карбида кремния
Карборунд используется при производстве полупроводниковой продукции, поскольку имеет высокую теплопроводность и плотность электротока. Его твердость делает из карбида кремния отличный абразив, который применяют для шлифовки, пескоструйной обработки, хонингования.
Карбид кремния можно встретить:
- в ювелирных цехах;
- в строительстве;
- в ядерной энергетике;
- в оборонной промышленности (в частности, для изготовления бронежилетов);
- в автомобилестроении (для дисковых прочных тормозных систем);
- в изготовлении мощной оптики и высокотемпературных печей;
- и так далее.
Работникам, контактирующим с карборундом, не обойтись без средств индивидуальной защиты, ведь искусственному минералу присвоен 4-й класс опасности. При контакте он способен нанести вред здоровью человека.
При соблюдении техники безопасности карбид кремния становится ключевым компонентом многих высокотехнологичных изделий. Объемы применения карборунда растут с каждым годом вместе с развитием промышленности в Российской Федерации и во всем мире.
Химические свойства углерода
Углерод способен образовывать несколько аллотропных модификаций. Это алмаз (наиболее инертная аллотропная модификация), графит, фуллерен и карбин.
Древесный уголь и сажа представляют собой аморфный углерод. Углерод в таком состоянии не имеет упорядоченной структуры и фактически состоит из мельчайших фрагментов слоев графита. Аморфный углерод, обработанный горячим водяным паром, называют активированным углем. 1 грамм активированного угля из-за наличия в нем множества пор имеет общую поверхность более трехсот квадратных метров! Благодаря своей способности поглощать различные вещества активированный уголь находит широкое применение как наполнитель фильтров, а также как энтеросорбент при различных видах отравлений.
С химической точки зрения аморфный углерод является наиболее активной его формой, графит проявляет среднюю активность, а алмаз является крайне инертным веществом. По этой причине, рассматриваемые ниже химические свойства углерода следует прежде всего относить к аморфному углероду.
Восстановительные свойства углерода
Как восстановитель углерод реагирует с такими неметаллами как, например, кислород, галогены, сера.
В зависимости от избытка или недостатка кислорода при горении угля возможно образование угарного газа CO или углекислого газа CO2:
При взаимодействии углерода со фтором образуется тетрафторид углерода:
При нагревании углерода с серой образуется сероуглерод CS2:
Углерод способен восстанавливать металлы после алюминия в ряду активности из их оксидов. Например:
Также углерод реагирует и с оксидами активных металлов, однако в этом случае наблюдается, как правило, не восстановление металла, а образование его карбида:
Взаимодействие углерода с оксидами неметаллов
Углерод вступает в реакцию сопропорционирования с углекислым газом CO2:
Одним из наиболее важных с промышленной точки зрения процессов является так называемая паровая конверсия угля. Процесс проводят, пропуская водяной пар через раскаленный уголь. При этом протекает следующая реакция:
При высокой температуре углерод способен восстанавливать даже такое инертное соединение как диоксид кремния. При этом в зависимости от условия возможно образование кремния или карбида кремния (карборунда):
Также углерод как восстановитель реагирует с кислотами окислителями, в частности, концентрированными серной и азотной кислотами:
Окислительные свойства углерода
Химический элемент углерод не отличается высокой электроотрицательностью, поэтому образуемые им простые вещества редко проявляют окислительные свойства по отношению к другим неметаллам.
Примером таких реакций является взаимодействие аморфного углерода с водородом при нагревании в присутствии катализатора:
а также с кремнием при температуре 1200-1300 оС:
Окислительные свойства углерод проявляет по отношению к металлам. Углерод способен реагировать с активными металлами и некоторыми металлами средней активности. Реакции протекают при нагревании:
Карбиды активных металлов гидролизуются водой:
а также растворами кислот-неокислителей:
При этом образуются углеводороды, содержащие углерод в той же степени окисления, что и в исходном карбиде.
Сферы применения
Карборунд используется во многих областях промышленности, т. к. обладает высокой устойчивостью к разрушению и воздействию экстремальных температур. Вот основные сферы его применения:
- В качестве конструкционного материала — из камня изготавливают тормоза для гоночных автомобилей, панели и плиты, элементы для военной техники, абразивные насадки и др.
- В электронике — на основе карбида кремния изготавливают полупроводниковые приборы (тиристоры), сверхбыстрые диоды и пр.
- В сталеварении — используется в качестве топлива для получения стали, а также в коррекции температурного режима при производстве металлических изделий.
- В ядерной энергетике — из минерала изготавливают покрытие для элементов ядерного топлива, добавляют в состав шлифовальных паст и др.
- В ювелирном деле — применяется в качестве муассанита (т. к. по внешнему виду напоминает алмаз), им украшают кольца, ожерелья, колье, браслеты, серьги, броши и т. д.
Также читайте: Мукаит – одна из разновидностей яшмы
Свойства минерала
| Цвет | Бесцветный до голубовато-зеленого и коричневатого с радужными переливами. |
| Происхождение названия | Название было придумано Эдвардом Ачесоном, т.к. он изначально думал что получил соединение углерода и корунда, поэтому назвал получившиеся кристаллы – Карборунд. Происходит от соединения латинского слова carbo – уголь и немецкого слова rund – круглый. |
| Год открытия | 1893 |
| IMA статус | не является минералом |
| Химическая формула | SiC |
| Блеск | полуметаллический |
| Прозрачность | прозрачный полупрозрачный просвечивает непрозрачный |
| Твердость | 9,5 |
| Плотность (расчетная) | 3.17 |
| Плотность (измеренная) | 3,12-3,22 |
Значение «затравочных кристаллов» для обеспечения роста кремниевых кристаллов
Оборудование для выращивания кристаллов, технология выращивания, исходный материал и затравочные кристаллы играют важную роль в процессах, используемых для производства и других полупроводников (включая кремний). Однако SiC в этом плане заметно отличается. Как будет объяснено более подробно далее, SiC-кристаллы выращиваются с помощью специальной технологии «паровой фазы». По этой причине диаметр затравочного чипа должен, как минимум, равняться диаметру выращиваемого кристалла. Невозможно вырастить большой кристалл высокого качества на «затравочной» пластине относительно небольшого диаметра, как это делается в случае с Si (рис. 1).
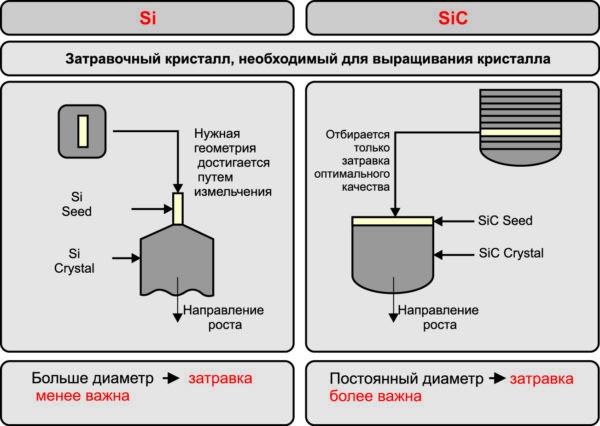
Рис. 1. Значение «затравочных» кристаллов для выращивания Si- и SiC-структур
Любые дефекты исходной структуры достанутся «в наследство» растущему кристаллу из-за «генетических» особенностей, описанных выше, поэтому при производстве SiC обязательно использование бездефектных затравочных кристаллов большого диаметра. Таким образом, их наличие является одним из факторов, обеспечивающих стабильную работу предприятия. На рынке нет предложения «затравочных» кристаллов, что является своего рода защитой от копирования. Этот материал всегда доступен в достаточном количестве у SiCrystal, где он надежно защищен собственными технологическими процессами.
Физико-химические характеристики
По химической классификации карборунд – это карбид кремния с простой формулой.

Тверже него только алмаз. Карборунд плотен, тугоплавок, равнодушен к истиранию, кислотам, прочим агрессивным веществам.
Карбид кремния:
- Плотность 3,05 г/см³.
- Состав 93 % карбида кремния.
- Предел прочности на изгиб 320…350 МПа.
- Предел прочности на сжатие 2300 МПа.
- Модуль упругости 380 ГПа.
- Твердость 87…92 HRC.
- Трещиностойкость в пределах 3.5 — 4.5 МПа·м1/2.
- Коэффициент теплопроводности при 100 °C, 140—200 Вт/(м·К).
- Коэфф. теплового расширения при 20-1000 °C, 3,5…4,0 К−1⋅10−6.
- Вязкость разрушения 3,5 МПа·м1/2.
Самосвязанный карбид кремния:
- Плотность 3,1 г/см³.
- Состав 99 % карбида кремния.
- Предел прочности на изгиб 350—450 МПа.
- Предел прочности на сжатие 2500 МПа.
- Модуль упругости 390—420 ГПа.
- Твердость 90…95 HRC.
- Трещиностойкость в пределах 4 — 5 МПа·м1/2.
- Коэффициент теплопроводности при 100 °C, 80 — 130 Вт/(м·К).
- Коэфф. теплового расширения при 20-1000 °C, 2,8…4 К−1⋅10−6.
- Вязкость разрушения 5 МПа·м1/2.
ВК6ОМ:
- Плотность 14,8 г/см³.
- Состав Карбид вольфрама.
- Предел прочности на изгиб 1700…1900 МПа.
- Предел прочности на сжатие 3500 МПа.
- Модуль упругости 550 ГПа.
- Твердость 90 HRA.
- Трещиностойкость в пределах 8-25 МПа·м1/2.
- Коэффициент теплопроводности при 100 °C, 75…85 Вт/(м·К).
- Коэфф. теплового расширения при 20-1000 °C, 4,5 К−1⋅10−6.
- Вязкость разрушения 10…15 МПа·м1/2.
Силицированный графит СГ-Т:
- Плотность 2,6 г/см³.
- Состав 50 % карбида кремния.
- Предел прочности на изгиб 90…110 МПа.
- Предел прочности на сжатие 300…320 МПа.
- Модуль упругости 95 ГПа.
- Твердость 50…70 HRC.
- Трещиностойкость в пределах 2-3 МПа·м1/2.
- Коэффициент теплопроводности при 10 °C, 100…115 Вт/(м·К).
- Коэфф. теплового расширения при 20-1000 °C, 4,6 К−1⋅10−6.
- Вязкость разрушения 3…4 МПа·м1/2.
Однако лучи света камень преломляет сильнее алмаза, по этому параметру сопоставим с муассанитом.
Методы получения SiC[править | править код]
Простейшим способом производства является спекание кремнезема с углеродом в графитовой электропечи Ачесона при высокой температуре 1800—2300 °C из смеси кварцевого песка (51—55%), кокса (35—40%) с добавкой NaCI (1—5%) и древесных опилок (5—10%). SiO2+3C→1600−2500oCSiC+2CO~\mathsf{SiO_2 + 3C \xrightarrow{1600-2500^oC} SiC + 2CO}
Чистота карбида кремния, образующегося в печи Ачесона, зависит от расстояния до графитового электрода в печи. Кристаллы высокой чистоты бесцветного, бледно-жёлтого и зелёного цвета находятся ближе всего к электроду. С увеличением расстояния от электрода цвет изменяется на синий или черный из-за присутствия примесей.
Сложно получать сверхчистые кристаллы SiC. Из-за высоких значений температуры и давления, при которых существует расплав карбида кремния, классические методы получения из него монокристаллов не применимы.
Используют методы выращивания кристаллов SiC из газовой фазы или из растворов в расплаве. Большое распространение получил метод сублимации. В этом методе рост кристаллов карбида кремния происходит из газовой фазы в графитовых тиглях в атмосфере инертных газов при температуре 2500-2600 °C. Эпитаксиальные слои и твердые растворы на основе карбида кремния можно получать всеми известными методами, используемыми в полупроводниковой технологии. Технология формирования структур карбида кремния на подложках кремния принципиально не отличается от процессов получения кремниевых пленок. Гетероэпитаксиальные слои выращиваются методом газофазной эпитаксии в открытой системе. В качестве газа-носителя используется водород диффузионной очистки; в первой зоне свободный углерод связывается с водородом и переносится в зону роста полупроводниковой пленки.
Карборунд: внешний вид и свойства
Будучи синтетическим, карбид кремния перенимает свойства природного муассанита. При этом его гораздо легче получить. Неорганическое бинарное углеродное соединение образует кристаллы, схожие внешне с антрацитом, но обладающие радужными переливами. Обычно кристаллы бесцветны и блестят, но технический карборунд порой приобретает различные цветовые оттенки из-за присутствия железных примесей.
Природный муассанит интересен своими уникальными свойствами. Он обладает поразительной, близкой к алмазу, твердостью, является инертным (не вступает в химические реакции с большинством кислот), выдерживает нагревание до 1500°С и воздействие радиации. Помимо этого, муассанит механически прочен и стабилен по части физических свойств. Редкость не позволяет использовать его полезные качества в промышленности, поэтому был создан синтетический аналог с теми же качествами.
Купить карбид кремния намного проще, чем муассанит. Его стоимость также ниже, что значительно повышает доступность.
Применение карборунда

Специалисты предсказывают карборунду довольно оптимистичное будущее. Его активное применение сегодня зафиксировано в таких областях человеческой деятельности, как автомобильная и металлургическая промышленность, астрономия, пирометрия, его даже применяют на практике в такой сфере, как электроника.
Конструкционный материал
С использованием карбида кремния изготавливают такие элементы, как:
- тормоза для спортивных авто;
- элементы бронированной военной техники. Это стало возможным благодаря повышенному уровню твердости исходного материала;
- шлифовальные порошки, активно использующиеся в различных отраслях промышленности, таких как металлургическая, электротехническая;
- высококачественные сопла и форсунки, а также распылители и насадки.
В ювелирном деле
Ученые долго и с интересом всматривались в пляшущие искорки света, что излучал муассанит, и, в конце концов, вынесли единодушный вердикт: камень идеален для изготовления элитных, эксклюзивных драгоценностей на любой вкус и цвет.
Шкатулки модниц по всему миру пополнились потрясающими украшениями с муассанитом: милыми колечками, всевозможными браслетами, подвесками – представители обоих полов сразу же оценили элегантный, вполне презентабельный внешний вид ювелирных изделий.
Коллекции дорогостоящих изделий сразу же пополнились украшениями, где чередуются брутальный аристократический и авангардный стили, где классика умело сочетается с романтизмом, и где арабский шик дополняется строгой европейской сдержанностью.
При помощи элитных украшений из муассанитов можно создать свой собственный имидж – причем образ твой может быть как строгим, респектабельным, так и по-лирически романтичным.
Даже самый простой, не цепляющий никакими деталями костюм, дополненный «холодными» украшениями, выделит тебя из серой, тучной толпы, привнесет в образ каплю благородства и неподдельной роскоши. При этом украшения из муассанита не отличаются крикливой броскостью, что не может не радовать.
Пьянительная роскошь камня и завораживающие глубина его света сделали невозможное, а именно – браслет с муассанитами на руке выглядит просто умопомрачительно, колечко на пальце – мило, и в то же время статусно.
Как полупроводник
Карбид кремния карборунд – отличный полупроводник, который:
- Обрел славу хорошего катализатора.
- Используется для изготовления высококачественных, стабильных светодиодов высокой мощности (достигающей 9 ватт).
- Применяется для производства лазера.
- Используется для изготовления терморезистора, всевозможных полупроводниковых устройств и полевого транзистора.
Таким образом, мауссанит – это «пришелец» из Космоса, который был дарован человеку по велению небес.
Структура и свойства

В природе существует более 250 кристаллических форм карборунда, которые могут разниться по свойствам и цветовой гамме. Кристаллическая решетка карборунда не имеет аналогов в мире, она уникальна, как и сам камень.
Но все виды карборундов, объединяет ряд качеств, а именно – это стойкость к влиянию кислот, повышенная химическая и термическая устойчивость, способность выдерживать высокие температуры вплоть до 1500 градусов по Цельсию.
Муассанит обладает исключительной красотой и прозрачностью, ни одни любые другие драгоценности на Земле не затмят его искрометный блеск! Даже бриллиант по сравнению с ним нервно побрякивает в сторонке.
Одно из самых полезных и нужных человечеству свойств карборунда – это его высокая стойкость к истиранию, поэтому участились случаи применения карборунда при строительстве станций метро и придорожных вокзалов.
Каждый год, каждый месяц, каждый час, каждую минуту и секунду по панелям и плитам, в состав которых включен мелкокристаллический карборунд, прошаркивают миллионы подошв.
К разряду наиболее важных свойств карборунда относят повышенный уровень термостойкости и поразительную устойчивость к влиянию кислот.
Химическая структура
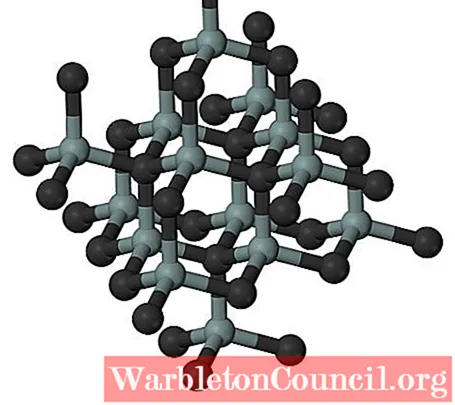
Верхнее изображение иллюстрирует кубическую и кристаллическую структуру карбида кремния. Это расположение такое же, как и у алмаза, несмотря на разницу в атомных радиусах между C и Si.
Все связи являются сильно ковалентными и направленными, в отличие от ионных твердых тел и их электростатических взаимодействий.
SiC образует молекулярные тетраэдры; то есть все атомы связаны с четырьмя другими. Эти тетраэдрические звенья соединены ковалентными связями, принимая слоистые кристаллические структуры.
Кроме того, эти слои имеют свои собственные кристаллы трех типов: A, B и C.
То есть слой A отличается от слоя B, а последний — от слоя C. Таким образом, кристалл SiC состоит из наложения последовательности слоев, явление, известное как политипизм.
Например, кубический политип (подобный алмазу) состоит из стопки слоев ABC и, следовательно, имеет кристаллическую структуру 3C.
Другие стопки этих слоев также образуют другие структуры между этими ромбоэдрическими и гексагональными политипами. Фактически, кристаллические структуры SiC превращаются в «кристаллический беспорядок».
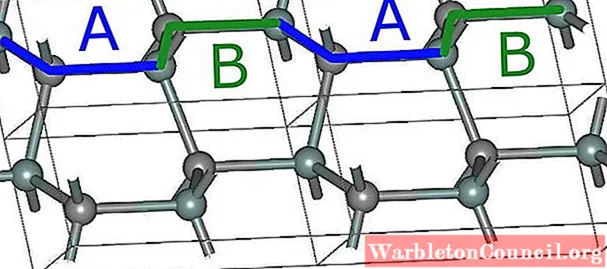
Простейшая гексагональная структура для SiC, 2H (верхнее изображение), образуется в результате наложения слоев с последовательностью ABABA … После каждых двух слоев последовательность повторяется, и отсюда идет цифра 2 .
История и происхождение
Карборунд научились получать синтетическим способом ещё с середины XIX века, но запатентовали только в 1893 году. До 2016 года производителем искусственного камня были США, сегодня же основным поставщиком его на мировой рынок признан Китай. В настоящее время выпускается порядка 250 модификаций карборунда разных цветов и оттенков. Камни, которые используются в ювелирной промышленности, покрывают специальной плёнкой, позволяющей выглядеть кристаллу сродни настоящему бриллианту.
В природе этот кристалл распространён в очень малом количестве, поэтому найти крупные залежи практически невозможно.
Применение кремния

В первую очередь, кремний применяется для получения материалов-полупроводников и кислотоупорных сплавов. Карбид кремния (SiC) часто используют для затачивания резцов станков и шлифовки ценных камней.
Из расплавленного кварца изготавливается устойчивую и крепкую кварцевую посуду.
Соединения кремния лежат в основе производства стекла и цемента.

Стекла отличаются друг от друга по составу, в котором обязательно присутствует кремний. Например, помимо оконных, существуют тугоплавкие, хрустальные, кварцевые, цветные, фотохромные, оптические, зеркальные и другие стекла.
При смешивании цемента с водой образуется особое вещество – цементный раствор, из которого впоследствии получают такой строительный материал, как бетон.
Производством этих веществ занимается силикатная промышленность. Помимо стекла и цемента, в силикатной промышленности получают кирпич, фарфор, фаянс и различные изделия из них.
Химические свойства
Схема атома кремния
В соединениях кремний склонен проявлять степень окисления +4 или −4, так как для атома кремния более характерно состояние sp³-гибридизации орбиталей. Поэтому во всех соединениях, кроме оксида кремния (II) SiO, кремний четырёхвалентен.
Химически кремний малоактивен. При комнатной температуре реагирует только с газообразным фтором, при этом образуется летучий тетрафторид кремния SiF4. При нагревании до температуры 400—500°C кремний реагирует с кислородом с образованием диоксида SiO2, с хлором, бромом и иодом — с образованием соответствующих легко летучих тетрагалогенидов SiHal4.
С водородом кремний непосредственно не реагирует, соединения кремния с водородом — силаны с общей формулой SinH2n+2 — получают косвенным путем. Моносилан SiH4 (его часто называют просто силаном) выделяется при взаимодействии силицидов металлов с растворами кислот, например:
Образующийся в этой реакции силан SiH4 содержит примесь и других силанов, в частности, дисилана Si2H6 и трисилана Si3H8, в которых имеется цепочка из атомов кремния, связанных между собой одинарными связями (—Si—Si—Si—).
С азотом кремний при температуре около 1000 °C образует нитрид Si3N4, с бором — термически и химически стойкие бориды SiB3, SiB6 и SiB12. Соединение кремния и его ближайшего аналога по таблице Менделеева — углерода — карбид кремния SiС (карборунд) характеризуется высокой твердостью и низкой химической активностью. Карборунд широко используется как абразивный материал.
При нагревании кремния с металлами возникают силициды. Силициды можно подразделить на две группы: ионно-ковалентные (силициды щелочных, щелочноземельных металлов и магния типа Ca2Si, Mg2Si и др.) и металлоподобные (силициды переходных металлов). Силициды активных металлов разлагаются под действием кислот, силициды переходных металлов химически стойки и под действием кислот не разлагаются. Металлоподобные силициды имеют высокие температуры плавления (до 2000 °C). Наиболее часто образуются металлоподобные силициды составов MeSi, Me3Si2, Me2Si3, Me5Si3 и MeSi2. Металлоподобные силициды химически инертны, устойчивы к действию кислорода даже при высоких температурах.
При восстановлении SiO2 кремнием при высоких температурах образуется оксид кремния (II) SiO.
Для кремния характерно образование кремнийорганических соединений, в которых атомы кремния соединены в длинные цепочки за счет мостиковых атомов кислорода —О—, а к каждому атому кремния, кроме двух атомов О, присоединены еще два органических радикала R1 и R2 = CH3, C2H5, C6H5, CH2CH2CF3 и др.
Свойства минерала

Благодаря камню можно избавиться от приступов лени и устранить страхи, которые мешают достижению целей. Карборунд имеет целебные и магические свойства, которые положительно влияют на жизнь человека. Камень является символом достатка и богатства в доме, он оказывает успокаивающее и умиротворяющее воздействия. Благодаря этому камню удается избавиться от психических расстройств, нарушения обмена веществ или патологии печени и почек. Карборунд избавляет человека от лени и безинициативности, способен нейтрализовать страхи и опасения на пути к цели. При длительном контакте с энергетически слабыми личностями способен спровоцировать бессонницу и стресс. Голубой самоцвет увеличивает сексуальную притягательность и умственные качества, поможет при нарушении памяти или после перенесенного нарушения мозгового кровообращения.
Магические свойства
Карборунд оказывает на человека такое воздействие:
- дарит гармонию с внутренним миром;
- обеспечивает спокойную и размеренную жизнь;
- приводит в гармонию окружающее пространство;
- исполняет желания;
- способствует взаимопониманию между членами семьи;
- защищает от отрицательного воздействия злых людей и сглазов;
- уберегает от дурных мыслей;
- заряжает положительными эмоциями;
- приносит любовь;
- сулит финансовый успех;
- избавляет от зависимостей;
- гармонизирует ауру;
- улучшает настроение и самочувствие.
Лечебные особенности

Самоцвет обладает лечебными действиями, которые направлены на успокоение нервов и устранения панических атак. Карборунд оказывает терапевтическое воздействие при таких патологических состояниях:
- психические расстройства;
- депрессия;
- паническая атака;
- фобии;
- галлюцинации;
- воспаление почек и мочевого пузыря;
- головная боль;
- истощение;
- нарушение обмена веществ;
- сбой иммунной системы;
- аутоиммунный процесс;
- гастрит или язвенная болезнь желудка;
- подагра;
- анемия;
- цирроз и гепатит.
Краткое описание
Оксид кремния (IV) SiO2 представляет собой твёрдое, тугоплавкое кристаллическое вещество, которое не растворяется в воде и не вступает с ней в реакцию. Химический компонент проявляет окислительные свойства. При температуре от +1000°C SiO2 взаимодействует с активными металлами. В этом случае образуется кремний:
- SiO2 + 2Mg = Si + 2MgO.
- 3SiO2 + 4Al = 3Si + 2Al2O3.
При избытке кремния происходит восстановление силицидов. Эта химическая реакция имеет следующую формулу: SiO2 + 4Mg = Mg2Si + 2MgO. Силициум взаимодействует с водородом, а при использовании углерода образуется карборунд: SiO2 + 3C = SiC + 2CO.
Если попробовать сплавить оксид кремния со щелочами, то в итоге можно будет получить силикаты:
- SiO2 + 2NaOH = Na2SiOO3 + H2O.
- SiO2 + CaO = CaSiO3.
- SiO2 + K2CO3 = K2SiO3 + CO2.
- SiO2 + H2O ≠.
При нормальном давлении и температуре воздуха можно выделить три кристаллические модификации SiO2: тридимит, кварц и кристобалит. В каждом случае известны высокотемпературные и низкотемпературные формы. В их основе лежат тетраэдры SiO4, которые соединены четырьмя атомами кислорода в трёхмерной решётке.
Свойства монооксида

На уроках химии можно узнать, что формула оксида кремния выглядит следующим образом — SiO2. Внешне это вещество имеет вязкую консистенцию, больше напоминает смолу. Без какого-либо воздействия оксид кремния отлично сохраняет своё конденсированное состояние, не подвержен окислению. SiO2 не влияет на образование солей, а также не пропускает ток. Получить монооксид кремния можно двумя доступными методами:
- Нагреть кремний до отметки +400°C и выше при недостаточном объёме кислорода. Формула выглядит следующим образом: 2Si + O2 → 2SiO.
- Использование специального метода Чохральского (выращивание монокристаллов путём вытягивания их вверх от свободной поверхности большого объёма расплава) при восстановлении диоксида в условиях высоких температур. Формула: 2SiO2 + Si → 2SiO.
В твёрдом состоянии монооксид представляет собой порошок коричневого цвета. Это химическое вещество обладает высокой прочностью и инертностью при условии взаимодействия с кислотами. Добиться полного растворения монооксида можно только в плавиковой кислоте. Среди основных химических свойств SiO2 можно выделить:
- Монооксид может разлагаться только под воздействием высоких температур. Отобразить эту реакцию можно с помощью следующей формулы: 2SiO → 2Si + О2.
- При нагревании монооксид взаимодействует с СО2. Формула: SiO + CO2 → SiO2 + CO.
- Монооксид кремния вступает в реакцию с парами Н2О, но только при условии нагревания до +500°C. Этот процесс хорошо виден в формуле: SiO + H2O → SiO2 + H2.
- Жидкий хлорид кремния можно получить в том случае, если дополнительно задействовать хлор и нагреть смесь до +800°C. Наглядно эта реакция выглядит так: 2SiO + 4Cl2 → 2SiCl4 + O2.
Характеристика диоксида
Оксид кремния (SiO2) представляет собой кристаллическое тугоплавкое вещество, которое не растворяется в воде. Этот химический компонент не проводит электрический ток. На уроках химии в 8 классе учащимся объясняют, что диоксид входит в состав следующих горных пород:

- Песка.
- Горного хрусталя.
- Яшмы.
- Кварца.
- Агата.
- Аметиста.
Литосфера на 87% состоит из диоксида. Это химическое вещество имеет немолекулярное строение. Атомы кислорода и кремния связаны ковалентным способом. Благодаря этому сформировалась кристаллическая решётка. Диоксид можно получить в лабораторных условиях. Для этого кремний вместе с кислородом нагревают до отметки +500°C: Si + O2 → SiO2.
После воздействия кислот на растворимые силикаты образуется диоксид. В итоге формируется кремниевая кислота, которая распадается на диоксид и воду. Химическая реакция выглядит следующим образом:
- Na2 SiO3 + 2CH3COOH → 2CH3COONa + H2SiO3↓.
- H 2SiO3 → H2O + SiO2.
В нормальных условиях диоксид вступает в реакцию только с плавиковой кислотой. А вот с основными оксидами и щелочами может взаимодействовать только при воздействии высоких температур. Диоксид не реагирует на Н2О. Сегодня это химическое вещество используется для серийного производства силикагеля, стекла и бетона.

































