Современная классификация нержавеющей стали
Нержавеющая сталь – это разновидность легированной стали, устойчивая к коррозии за счет содержания хрома. В присутствии кислорода образуется оксид хрома, который создает на поверхности стали инертную пленку, защищающую все изделие от неблагоприятных воздействий.

Не каждая марка нержавеющей стали демонстрирует устойчивость хромоксидной пленки к механическим и химическим повреждениям. Хотя пленка восстанавливается под воздействием кислорода, были разработаны специальные марки нержавейки для применения в агрессивных средах.
Первый условный тип разбиения на группы:
- Пищевая
- Жаропрочная сталь
- Кислотостойкая сталь
Второй тип классификации — по микроструктуре:
- Аустенитные (Austenitic) — не магнитная сталь с основными составляющими 15-20% хрома и 5-15% никеля который увеличивает сопротивление коррозии. Она хорошо подвергается тепловой обработке и сварке. Именно аустенитная группа сталей наиболее широко используется в промышленности и в производстве элементов крепежа.
- Мартенситные (Martensitic) — значительно более твердые чем аустетнитные стали и могут быть магнитными. Они упрочняются, закалкой и отпуском подобно простым углеродистым сталям, и находят применение главным образом в изготовлении столовых приборов, режущих инструментов и общем машиностроении. Больше поддвержены коррозии.
- Ферритные (Ferritic) стали значительно более мягкие чем мартенситные по причине малого содержания углерода. Они также обладают магнитными свойствами.
Получение молибдена
Сырье, из которого производится металлический молибден – молибденовые концентраты. В их составе данного элемента содержится около 50%. Также в них содержатся: сера ~ 30%, оксид кремния (до 9%) и около 20% прочих примесей.
На следующем этапе удаляют примеси для получения чистого оксида молибдена. Применяются два способа:
- Возгонка при температуре 950 °С — 1100 °С.
- Химическое выщелачивание. Суть способа в том, что при взаимодействии с аммиачной водой устраняются примеси меди и железа и получается карбид молибдена, который кристаллизуют выпаркой или нейтрализацией. Далее карбид нагревают и выдерживают при температуре до 500°С. На выходе – чистый оксид МоО3, в котором содержание примесей всего 0,05%.
Производство молибдена основано на восстановлении МоО3. Процесс проводят в два этапа:
- В трубчатой печи при температуре 550°С — 700°С в потоке сухого водорода происходит отделение атомов кислорода.
- Далее температура поднимается до 900°С — 1000°С и происходит окончательное восстановление. Полученный металл находится в виде порошка.
Для получения монолитного металла пользуются плавлением или спеканием порошка. Плавку используют, когда получают заготовки массой от 500 кг. Процесс производят в дуговых печах с охлаждаемым тигелем, в который подается расходуемый электрод из ранее спеченных штабиков.

Получение молибдена
Порошковое спекание – это прессование в атмосфере водорода при высоких значениях давления (2000-3000 атмосфер) и температуры (1000°С — 1200°С). Полученные штабики, подвергаются спеканию при высоких температурах равных 2200°С — 2400°С. В дальнейшем молибдену придается необходимая форма за счет обработки давлением – ковкой, прокаткой, протяжкой.
Широко в промышленности используется ферромолибден, в котором до 60-70% молибдена, а оставшееся — железо. Его получают путем введения в сталь молибденовых присадок. Сплав получают путем восстановления огарка силикатом железа с добавками стальной стружки и железистой руды.
Переработка молибденового сырья.
Перед химической переработкой молибденсодержащую руду нужно обогатить. Основным методом обогащения молибденитовых руд является флотация – способ разделения мелких частиц различных веществ, основанный на различной их смачиваемости и накоплении на поверхности раздела фаз. Сначала молибденитовая руда предварительно измельчается в дробилках, затем в шаровых мельницах, а потом поступает на коллективную сульфидную флотацию. С помощью этого процесса удается получить концентрат, содержащий до 10% молибдена. Полученный молибденовый концентрат поступает далее на селективную флотацию с применением специальных реагентов, в процессе которой (при заданном значении рН) происходит селективное отделение MoS2 от других сульфидов (халькопирита и пр.). Повторяя этот процесс 5–6 раз (с промежуточным измельчением), получают, в зависимости от технологии и первоначального минералогического состава, качественный молибденовый концентрат с содержанием Mo 48-58,6%, Сu 0,01–2,2%. Следует отметить высокую степень извлечения молибденита в процессе флотации, составляющую 90–95% и выше.
Первой и важнейшей стадией в процессе химической переработки молибденитового концентрата является обжиг, который позволяет избавиться от нежелательных примесей: серы, воды и остатков флотореагентов. В результате обжига происходит целевая реакция окисления дисульфида молибдена до триоксида 2MoS2 + 7O2 = 2MoO3 + 4SO2 и множество других побочных процесов, заметно влияющих на последующее извлечение молибдена:
6CuFeS2 + 19O2 = 2Fe3O4 + 6CuO + 12SO2
MoO3 + CaCO3 = CaMoO4 + CO2
MoO3 + CuO = CuMoO4
MoO3 + PbO = PbMoO4.
Температурный режим и эффективность обжига зависят от многих факторов, прежде всего от степени измельчения концентрата.
Огарок, содержащий молибденовый ангидрид, переводят либо в парамолибдат аммония или чистый MoO3, либо в молибдат кальция. Из двух первых можно в дальнейшем получить любые соединения молибдена, в том числе высокочистые. Наибольшее распространение при извлечении молибдена из огарков высококачественных концентратов получил аммиачный метод, так как в 8–10% водном аммиаке растворяется молибденовый ангидрид, и не растворяется большинство примесей, сопутствующих ему в огарке. В зависимости от состава концентрата и условий обжига удается извлечь 80–95% молибдена. Не извлеченный MoO3 перерабатывается по дополнительной схеме. Из аммиачного раствора молибдата аммония молибден можно извлекать в виде парамолибдата аммония (NH4)6Mo7O24·4H2O, молибденовой кислоты H2MoO4 или молибдата кальция CaMoO4.
Помимо аммиачного извлечения молибденового ангидрида иногда практикуется его возгонка из огарков (если в них мало содержание нелетучих молибдатов) в интервале температур 900–1000° С, которая позволяет получать MoO3 чистотой 99,95%.
Какие физические свойства имеет металл магний
Видео: Магний – металл, который горит
Легкость элемента отображает плотность, которая составляет 1,74 г/см3. Меньшую имеют только кальций и щелочные металлы. Физические свойства магния можно коротко описать стандартными энциклопедическими параметрами:
- Т плавления – 651°С;
- Т кипения – 1107°С;
- Теплопроводность – 0,376 кал/(см·с·град) достаточно высока, сравнима с тем, что демонстрируют бериллий и вольфрам;
- Теплоемкость при Т плавления – 0,3 кал/град;
- Удельная теплоемкость увеличивается до Т плавления и уменьшается по ее достижении;
- Усадка при смене состояний (жидкость – твердое тело) – 3,97-4,2%;
- Удельное электросопротивление при комнатной температуре – 0,047 ом·мм2/м.
Этот элемент периодической таблицы Менделеева относят к щелочноземельным металлам. Однако это утверждение не всегда верно, поскольку химические свойства приближают этот элемент к алюминий подобным веществам.
Так выглядит оксид магния
Оксиды MgO относят к белым тугоплавким веществам, их называют жженой магнезией и применяют при изготовлении строительных материалов. Соли магния металла образуются при взаимодействии вещества с кислотами. Наиболее известная из них MgCO3. Используется металлургам для освобождения сплавов от шлаков, называют карбонат магния. Еще одна соль MgSO4 – известна как горькая или английская. Химики ее именуют сульфат магния. Mg и Ca влияют на жесткость воды. Высокая концентрация этих веществ в Н2О не позволяет моющим средствам пениться.
Магниевый сплав МЦр1Н3
Чтобы более детально ответить на то, какие физические свойства имеет магний, необходимо рассматривать изменения его состояний и качеств по мере применения к нему различных тепловых эффектов: нагревание и охлаждение. Так, например, плотность снижается на 6% при Т – 6000С, расплавившись и вовсе падает до значения 1.58 г/см3.
Характеристики металла магния сильно отличаются при низких и высоких температурах. Некоторые результаты экспериментов требуют объяснения, часть из них дают вполне предвиденные реакции.
Гексагональная решетка элемента имеет следующие параметры:
- с = 5,199 ангстрем;
- а = 3,202 ангстрем.
При нагревании до 6270С эти расстояния увеличиваются, дойдя до температуры плавления связи решетки разрушаются вовсе.
Если говорить о том, какого цвета магний придется отметить, что в целом серебристо-белый металл, может выглядеть как черный обуглившийся с присущим блеском. В последнем случае речь идет о стружке магния. Поэтому определяя «на глаз» тип материала, все-таки лучше обратиться к химическим экспериментам, если под рукой не имеется спектрального анализатора.
Классическая задача для школьников рассматривает ряд натрий – магний –алюминий, металлические свойства которого ослабевает от первого к последнему элементу.
Маркировка нержавеющей стали
В России и странах СНГ принята буквенно-цифровая система, согласно которой цифрами обозначается содержание элементов стали, а буквами — наименование элементов. Общими для всех обозначениями являются буквенные обозначения легирующих элементов: Н — никель, Х — хром, К — кобальт, М — молибден, В — вольфрам, Т — титан, Д — медь, Г — марганец, С — кремний.
Стали нержавеющие стандартные, согласно ГОСТ 5632-72, маркируют буквами и цифрами (например, 08Х18Н10Т). В США существует несколько систем обозначения металлов и их сплавов. Это объясняется наличием нескольких организаций по стандартизации, к ним относятся АMS, ASME, ASTM, AWS, SAE, ACJ, ANSI, AJS. Вполне понятно, что такая маркировка требует дополнительного разъяснения и знания при торговле металлом, оформлении заказов и т. п.
Европа (EN)
Германия (DIN)
США (AISI)
Япония (JIS)
СНГ (ГОСТ)
Из всего многообразия марок мы используем в своём производстве три основные — AISI 304, AISI 316 и AISI 430.
Где применяется молибден?
В истории самое первое применение молибдена было зафиксировано в Японии еще в 10-13 ст. Существует вероятность, что в те далекие времена, данный металл служил материалом для изготовления холодного оружия.
Сегодня молибденовая промышленность является достаточно развитой отраслью. И, кроме того, что в настоящее время продолжают производить чистый молибден и его сплавы, также существует множество его марок, каждая из которых предназначена для определенных целей. Самые известные марки молибдена:
- МЧ — чистый молибден без присадок. Из этой марки производятся держатели вольфрамовых спиралей и нити накаливания, аноды генераторных ламп.
- МЧВП — чистый молибден без присадок, произведенный методом вакуумной плавки.
- МРН — молибден разного назначения, не содержит присадок, включает большее количество примесей по сравнению с марками МЧ и МЧВП. Предназначена для использования в производстве высокотемпературных нагревателей, экранов, электрических вводов в вакуумные приборы и установки.
- МК — содержит кремнещелочную присадку.
- ЦМ — в качестве присадки используются цирконий и/или титан.
- МР — сплав молибдена с рением.
- МВ — сплав молибдена с вольфрамом.
Таким образом, спустя целые столетия, молибден стал незаменимым компонентом во многих промышленных отраслях. Он применяется:
- в качестве легирующего элемента стали;
- при производстве жаропрочных сплавов, без которых не обходится авиационная, ракетная и ядерная техника;
- для изготовления сплавов, обладающих антикоррозионными свойствами;
- во время производства деталей электровакуумных приборов, нитей ламп накаливания;
- для изготовления лопаток турбин;
- в энергетических ядерных реакторах;
- в качестве смазочных материалов, а также катализатора гидрогенизации;
- при изготовлении лакокрасочных материалов;
- в химической, нефтяной промышленности, а также в металлургии.
Применение
Около 3⁄4 всего производимого редкоземельного металла используется как легирующий элемент при производстве сталей. Оставшаяся 1⁄4 часть используется в чистом виде и в химических соединениях. Применение он нашел во многих отраслях промышленности.
- Космическая область и авиастроение. Изделия из молибдена и его сплавов нашли применение для облицовки и изготовления головок ракет и носов самолетов, летающих на скоростях выше звуковых. Использование как конструкционный материал – это обшивка, а как тепловой экран – головная часть.
- Металлургия. Применение молибдена в литейном производстве и металлургии обусловлено высокой прокаливаемостью. Следовательно, повышается прочность, коррозионная стойкость, вязкость. В его сплавах с кобальтом или хромом заметно повышается твердость. Из легированных сталей с молибденовыми добавками изготавливаются ответственные детали. Его добавляют в жаро- и кислотоустойчивые сплавы. Поэтому большинство инструментов, производящих горячую обработку, изготавливаются из сталей, легированных Мо.
- Химическая промышленность. Из материалов с Мо, обладающих кислотоустойчивостью, изготавливают различные аппараты для производства кислот или их переработки. Нагреватели печей, внутри которых водородная среда также изготавливаются из молибденовых сплавов. Также данный металл можно найти в составе некоторых лаков, красок, эмалей и термически наносимых глазурей. Используют металл и как катализатор для химических реакций.
- Радиоэлектроника. Мо — незаменимый материал для изготовления электроосветительных и электронно-вакуумных приборов, среди которых многим известны радиолампы.
- Медицина. В медицине элемент используется при изготовлении рентгеновских аппаратов.
- Изделия из стекла. Из-за плавления при высокой температуре Мо используют при плавлении стекла.
Характеристика материала
Физические свойства. Молибден – редкоземельный металл серого цвета, внешне похож на свинец. Температура плавления 2619 ºС.

Отличается повышенной пластичностью. Модуль Юнга 336 ГПа, что в 1,5 раза больше, чем у стали. Плотность составляет 10,2 г\см3. Самым жаростойким металлом считается вольфрам. Но касаемо удельной жаропрочности при температурах до 1400 ºС, молибден не имеет конкурентов. Молибден имеет низкое значение коэффициента линейного расширения. При изменении температуры на 1000 ºС, его размер увеличится всего на 0,0049 мм.
Теплопроводность составляет 300 Вт\м К. Электросопротивление 5,6 мкОМ см. После предварительной механической и термической обработок прочность металла может составлять 20-23 кг\мм2. Обладает парамагнитными свойствами.
Среди недостатков отметим низкую пластичность при температурах ниже -30 ºС.
Химические свойства. Молибден полностью устойчив к воздействию окружающей среды в обычных атмосферных условиях. Процесс окисления начинается при 420 ºС, образуя соединение низкой твердости оксид молибдена.
Молибден инертен к водороду при температуре до 2620 ºС. Нейтрален к таким элементам как углерод, фтор, кремний, азот, сера. Молибден не вступает в химические реакции с основными видами кислот: соляная, серная, азотная, фтористая.
Технологические свойства. В условиях комнатной температуры молибденовый круг радиусом 5 мм может быть завязан в узел без использования специального оборудования или быть раскатанным до толщины 0,1 мм. Такая податливость металла способствует получению разных видов профильного проката.
Молибден хорошо обрабатывается методом резания при условии применения смазочно-охлаждающей жидкости на основе серы.
Молибден не выделяется качеством сварных швов. Относится к 3 группе свариваемости. Процесс сварки осуществляется дуговым методом. Для придания сварным соединениям большей пластичности зона контакта должна находиться в среде защитных газов. Предпочтение здесь отдается гелию или аргону.
Биологические свойства. Молибден содержится в организме человека в пределах 8-10 мг. Прежде всего, он влияет на протекание анаболических процессов. Усиливает воздействие витамина С, тем самым способствует усилению иммунной системы. Молибден является регулятором меди, предотвращает ее накапливание в крови.
Молибденовые сплавы имеют характерную особенность химического состава – низкий процент содержания легирующих элементов. Только двухкомпонентные твердые растворы имеют значительный процент вольфрама в своем составе (до 50%).
Основными отечественными марками молибденового сплава являются:
- Молибденовый сплав ЦМ-2А. Легирующими добавками служат титан (0,07-03%) и цирконий (0,07-0,15%). Помимо данных элементов может включать карбидные фазы (до 0,004%). Предел прочности составляет 30 кг\мм2. Значительно падает после прохождения температурного порога в 1200 С. Основные преимущества сплава – технологичность и пластичность, которые дают возможность получения из него производственных полуфабрикатов.
- Молибденовый сплав ВМ-1 значительно не отличается от вышеописанного сплава. Имеет аналогичные показатели как химических, так и механических свойств.
- Молибденовый ВМ-2 имеет в своем составе больший процент циркония, делая его более жаростойким. Это позволяет ему выдерживать температуры в 1300-1400 С окружающей среды. Обладает пределом прочности 48 кг\мм2, в 1,6 раза выше чем у ЦМ-2А.
- Дополнительное легирование молибденового сплава ВМ-3 титаном (1,3%), цирконием (0,6%), ниобием (1,8%) приводит к дальнейшему увеличению жаропрочности. Выдерживает нагрузки до 27 кг\мм2 при температуре до 1360 С. Однако ВМ-3 имеет пониженный уровень пластичности. Это делает его менее технологичным и ограничивает применение в производстве.
Свойства молибдена (таблица): температура, плотность, давление и пр.:
Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения | |
| 101 | Название | Молибден |
| 102 | Прежнее название | |
| 103 | Латинское название | Molybdaenum |
| 104 | Английское название | Molybdenum |
| 105 | Символ | Mo |
| 106 | Атомный номер (номер в таблице) | 42 |
| 107 | Тип | Металл |
| 108 | Группа | Переходный, тяжёлый металл |
| 109 | Открыт | Карл Вильгельм Шееле, Швеция, 1778 г. |
| 110 | Год открытия | 1778 г. |
| 111 | Внешний вид и пр. | Блестящий металл серебристо-белого цвета |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,00011 % |
| 120 | Содержание в морях и океанах (по массе) | 1,0·10-6 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 5,0·10-7 % |
| 122 | Содержание в Солнце (по массе) | 9,0·10-7 % |
| 123 | Содержание в метеоритах (по массе) | 0,00012 % |
| 124 | Содержание в организме человека (по массе) | 0,00001 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 95,96(2) а. е. м. (г/моль) |
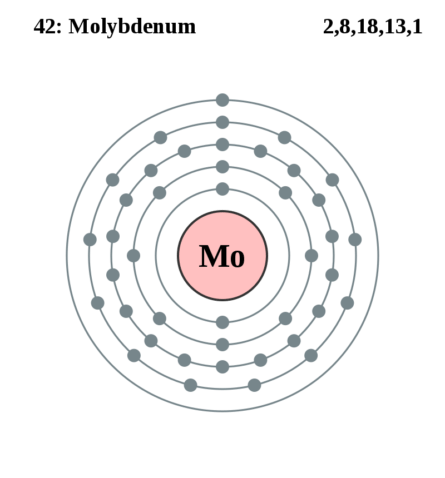
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d5 5s1 |
| 203 | Электронная оболочка | K2 L8 M18 N13 O1 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 190 пм |
| 205 | Эмпирический радиус атома* | 154 пм |
| 206 | Ковалентный радиус* | 154 пм |
| 207 | Радиус иона (кристаллический) | Mo3+ 83 (6) пм,
Mo4+ 79 (6) пм Mo5+ 75 (6) пм, Mo6+ 73 (6) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | |
| 209 | Электроны, Протоны, Нейтроны | 42 электрона, 42 протона, 54 нейтрона |
| 210 | Семейство (блок) | элемент d-семейства |
| 211 | Период в периодической таблице | 5 |
| 212 | Группа в периодической таблице | 6-ая группа (по старой классификации – побочная подгруппа 6-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | -4, -2, -1, 0, +1,+2, +3, +4, +5, +6 |
| 302 | Валентность | II, III, IV, V, VI |
| 303 | Электроотрицательность | 2,16 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 684,32 кДж/моль (7,09243(4) эВ) |
| 305 | Электродный потенциал | Mo3+ + 3e– → Mo, Eo = -0,2 В |
| 306 | Энергия сродства атома к электрону | 71,9 кДж/моль |
| 400 | Физические свойства | |
| 401 | Плотность* | 10,28 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело), 9,33 г/см3 (при температуре плавления 2623 °C и иных стандартных условиях, состояние вещества – жидкость) |
| 402 | Температура плавления* | 2623 °C (2896 K, 4753 °F) |
| 403 | Температура кипения* | 4639 °C (4912 K, 8382 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 37,48 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 598 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,251 Дж/г·K (при 25 °C), 0,272 Дж/г·K (при 0-100 °C) |
| 410 | Молярная теплоёмкость* | 24,06 Дж/(K·моль) |
| 411 | Молярный объём | 9,4 см³/моль |
| 412 | Теплопроводность | 138 Вт/(м·К) (при стандартных условиях), 138 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
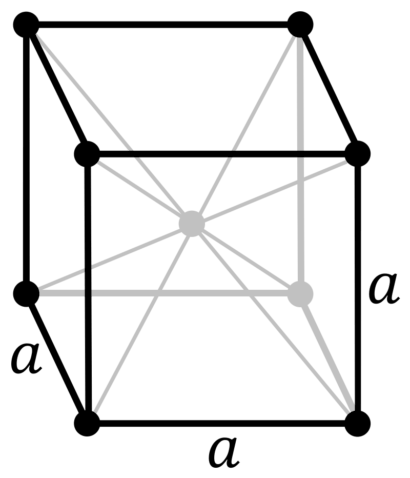
| 512 | Структура решётки | Кубическая объёмно-центрированная
|
| 513 | Параметры решётки | 3,147 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 450 K |
| 516 | Название пространственной группы симметрии | Im_ 3m |
| 517 | Номер пространственной группы симметрии | 229 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7439-98-7 |
Примечание:
205* Эмпирический радиус атома молибдена согласно и составляет 139 пм.
206* Ковалентный радиус молибдена согласно и составляет 154±5 пм и 130 пм соответственно.
401* Плотность молибдена согласно и составляет 10,22 г/см3 (при 0 °C/20 °C и иных стандартных условиях, состояние вещества – твердое тело).
402* Температура плавления молибдена согласно составляет 2620 °С (2893,15 K, 4748 °F).
403* Температура кипения молибдена согласно и составляет 4611,85 °С (4885 K, 8333,33 °F) и 4630 °С (4903,15 K, 8366 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) молибдена согласно и составляет 28 кДж/моль и 36,4 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) молибдена согласно составляет 582,4 кДж/моль.
410* Молярная теплоёмкость молибдена согласно составляет 23,93 Дж/(K·моль).
Тугоплавкий металл молибден
Молибден и его сплавы относятся к тугоплавким материалам. Для изготовления обшивки головных частей ракет и самолетов тугоплавкие металлы и сплавы на их основе используют в двух вариантах. В одном из вариантов эти металлы служат лишь тепловыми экранами, которые отделены от основного конструкцнонного материала теплоизоляцией. Во втором случае тугоплавкие металлы и их сплавы служат основным конструкционным материалом. Молибден занимает второе место после вольфрама и его сплавов по прочностным свойствам. Однако, по удельной прочности при температурах ниже 1350-1450°С Mo и его сплавы занимают первое место. Таким образом, наибольшее распространение для изготовлеиия обшивки и элементов каркаса ракет и сверхзвуковых самолетов получают молибден и ниобий и их сплавы, обладающие большей удельной прочностью до 1370°С по сравненню с танталом, вольфрамом и сплавами на их основе. Из Mo изготовляют сотовые панели космических летательных аппаратов, теплообменники, оболочки возвращающихся на землю ракет и капсул, тепловые экраны, обшивку кромок крыльев и стабилизаторы в сверхзвуковых самолетах. В очень тяжелых условиях работают некоторые детали прямоточных ракетных и турбореактивных двигателей (лопатки турбин, хвостовые юбки, заслонки форсунок, сопла ракетных двигателей, поверхности управления в ракетах с твердым топливом). При этом от материала требуется не только высокое сопротивление окислению и газовой эрозии, но и высокая длительная прочность и сопротивление удару. При температурах ниже 1370°С для изготовления данных деталей используют молибден и его сплавы.
Молибден — перспективный материал для оборудования, работающего в среде серной, соляной и фосфорной кислот. В связи с высокой стойкостью данного металла в расплавленном стекле его широко используют в стекольной промышленности, в частности для изготовления электродов для плавки стекла. В настоящее время из молибденовых сплавов изготавливают прессформы и стержни машин для литья под давлением алюминиевых, цинковых и медных сплавов. Высокая прочность и твердость таких материалов при повышенных температурах обусловили их применение в качестве инструмента при горячей обработке сталей и сплавов давлением (оправки прошивных станов, матрицы, прессштемпели).
Молибден существенно улучшает свойства сталей. Присадка Mo значительно повышает их прокаливаемость. Небольшие добавки Mo (0,15-0,8 %) в конструкционные стали настолько увеличивают их прочность, вязкость и коррозионную стойкость, что они используются при изготовлении самых ответственных деталей и изделий. Для повышения твердости молибден вводят в сплавы кобальта и хрома (стеллиты), которые применяют для наплавки кромок деталей из обычной стали, работающих на износ (истирание).Также он входит в состав ряда кислотоупорных и жаростойких сплавов на основе никеля, кобальта и хрома.
Еще одной областью применения является производство нагревательных элементов электропечей, работающих в атмосфере водорода при температурах до 1600°С. Также молибден широко используется в радиоэлектронной промышленности и рентгенотехнике для изготовления различных деталей электронных ламп, рентгеновских трубок и других вакуумных приборов.
Соединения молибдена — сульфид, оксиды, молибдаты — являются катализаторами химических реакций, пигментами красителей, компонентами глазурей. Также данный металл как микродобавка входит в состав удобрений. Гексафторид молибдена применяется при нанесении металлического Mo на различные материалы. МоSi2 используется как твердая высокотемпературная смазка. Чистый монокристаллический Mo используется для производства зеркал для мощных газодинамических лазеров. Теллурид молибдена является очень хорошим термоэлектрическим материалом для производства термоэлектрогенераторов (термо-э.д.с 780 мкВ/К). Трехокись молибдена (молибденовый ангидрид) широко применяется в качестве положительного электрода в литиевых источниках тока. Дисульфид MoS2 и диселенид МоSе2 молибдена используют в качестве смазки трущихся деталей, работающих при температурах от -45 до +400°С. В лакокрасочной и легкой промышленности для изготовления красок и лаков и для окраски тканей и мехов в качестве пигментов применяют ряд химических соединений Mo.
Витамины с молибденом
3). Помимо монопрепаратов существуют и комплексные витамины с молибденом для полноценного обеспечения организма основными питательными веществами. Одним из лучших среди них является мультиминеральная и мультивитаминная добавка для взрослых «Sentry, Multivitamin & Multimineral Supplement, Adults» (300 таблеток) от производителя 21st Century.
В ее состав входит комплекс из 30 жизненно важных питательных веществ, в том числе:
- витамин A,
- витамин B1,
- витамин B2,
- витамин B3,
- витамин B5,
- витамин B6,
- витамин B12,
- витамин C,
- витамин E,
- витамин K,
- фолиевая кислота,
- биотин,
- кальций,
- железо,
- фосфор,
- йод,
- магний,
- цинк,
- селен,
- медь,
- марганец,
- хром,
- молибден,
- калий,
- бор,
- олово,
- никель,
- кремний,
- ванадий.
Формула препарата разработана с учетом рекомендуемой суточной нормы каждого из перечисленных компонентов, что обеспечивает полное удовлетворение потребностей организма.
Рекомендации по применению: принимать по 1 таблетке в день во время еды или по рекомендации врача.
Сплавы молибдена
Используется два сплава на основе данного металла: с вольфрамом (МВ) и рением (МР).
Сплавы молибдена с вольфрамом необходимы для повышения жаропрочности первого. При этом ухудшается деформируемость и повышается удельный вес. В таких сплавах содержится от 48 % вольфрама и от 49 до 51 % молибдена, остальное — примеси. МВ является тугоплавким, отличается высокой прочностью и устойчивостью к коррозии. Используется для изготовления тонкой проволоки, которая сворачивается в катушки или бухты.
Рений необходим для повышения пластичности молибдена. Сплавы МР содержат более 50 % рения и около 47 % молибдена. Они также используются для производства тонкой проволоки, которая применяется в специальном приборостроении.
Основные марки молибдена
В промышленности используется чистый молибден и с различными присадками. Среди наиболее распространенных можно выделить следующие марки:
Этапы производства:
- Концентрат подвергают окислительному обжигу при температуре 600 ⁰С. На выходе получают оксид молибдена, который содержит значительное количество примесей.
- Оксид очищают от примесей путем выгонки или выщелачивания огарка и дальнейшей нейтрализации.
- В трубчатой печи из чистого оксида получают порошковый металлический молибден. Для этого процесса применяют ток сухого водорода.
- Порошок превращают в металл. Как правило, для этого используют один из двух методов — плавка или порошковая металлургия.
Для получения ферромолибдена применяется реакция восстановления молибденитового концентрата, который предварительно подвергается обжигу.



Молибден в организме человека
Молибден относится к микроэлементам, необходимым человеку. Он содержится преимущественно в костях, почках и печени, а также в головном мозге, щитовидной и поджелудочной железах, надпочечниках.
Роль и функции молибдена для организма:
Суточная потребность в молибдене составляет от 70 до 300 мкг в зависимости от массы тела. В случае дефицита микроэлемента в организме и болезней, которые им вызваны, суточная норма увеличивается.
История и происхождение названия
Открыт в 1778 г. шведским химиком Карлом Шееле, который прокаливая молибденовую кислоту, получил оксид МоО3. В металлическом состоянии впервые получен П. Гьельмом в 1782 г. восстановлением оксида углём: он получил молибден, загрязненный углеродом и карбидом молибдена. Чистый молибден в 1817 году получил Й. Берцелиус. Название происходит от греч. μολυβδος, означающего «свинец». Оно дано из-за внешнего сходства молибденита (MoS2), минерала из которого впервые удалось выделить оксид молибдена, со свинцовым блеском (PbS). Вплоть до XVIII в. молибденит не отличали от графита и свинцового блеска, эти минералы носили общее название «молибден».
Анализ и синтез
Новый металл и его соединения заинтересовали химиков XIX столетия. Чистый молибден при хранении совершенно не изменялся, он прекрасно противостоял действию влаги и воздуха. Но так было лишь при невысоких температурах: стоило нагреть его, и он начинал реагировать с кислородом; при температуре около 500°C он превращался в окисел целиком. Это, конечно, огорчало. Металл с хорошими физикомеханическими свойствами и к тому же тугоплавкий при сравнительно небольшом нагреве терял металлические свойства. Это обстоятельство (вместе со сложностью получения металлического молибдена) надолго отсрочило время, когда этот металл нашел первое практическое применение.
Соединения элемента № 42 стали применять намного раньше. В 1848 г. русский химик Г. В. Струве вместе со шведом Л. Сванбергом изучал свойства молибденового ангидрида и образуемой им кислоты. Они растворили MoO3 в концентрированном растворе аммиака и к полученному раствору прилили винного спирта. Выпал осадок канареечно- желтого цвета — молибдат аммония. Этой соли суждено было сыграть большую роль в аналитической химии.
Как раз в эти годы возникала наука о плодородии, как раз в это время благодаря работам Либиха и других ученых довольно бурно развивалась агрохимия. Специальные фабрики стали вырабатывать удобрения, содержащие фосфор и азот. И сразу понадобились реактивы, с помощью которых можно было бы легко и точно определять содержание этих элементов в различных веществах.
Полученный Струве и Сванбергом молибдат аммония оказался прекрасным реактивом на фосфор — реактивом, полностью осаждающим фосфор из растворов, позволяющим определить его содержание в любых продуктах — туках, металлах, рудах. Реактив оказался настолько хорош, что и сегодня им охотно пользуются в аналитических лабораториях, когда нужно определить содержание фосфора в образце.
Молибдат аммония нашел и другое применение. Оказалось, что он губительно действует на микроорганизмы, и его стали применять в качестве дезинфицирующего средства. Первоначально шелковые и хлопчатобумажные ткани пропитывали этим веществом только ради того, чтобы продлить срок их службы. Но позже открылась еще одна особенность воздействия этого вещества на ткань.
Если пропитанную молибдатом аммония ткань протянуть затем через раствор восстановителя (хлористого олова), то она и зависимости от концентрации реактивов окрашивается в небесно-голубой или синий цвет. Это вообще характерно для кислых растворов солеи молибденовой кислоты: под действием восстановителей они синеют. Такую краску называют молибденовой синью, или минеральным индиго. Было составлено много рецептов для окрашивания тканей молибденовыми солями не только в синий, но и красный, желтый, черный, бурый цвета. Окрашивали этими солями шерсть, мех, кожу, дерево и резину. Использовали молибденовые соединения и для приготовления лаков, и для окраски керамики. Например, фарфор окрашивается в голубой цвет молибдатом натрия, а в желтый — все тем же молибдатом аммония. Очень ценится оранжевая краска из молибдата и хромата свинца.
А сернистый молибден, из которого в давние времена делали карандаши, стали добавлять к глине, окрашивая керамические изделия при обжиге в желтый или красный цвет (в зависимости от количества MoS2).